NCS - TUTORIA - 29/05/23 - SP 3.5
- thikow

- 29 de mai. de 2023
- 45 min de leitura
SP 3.5 – Diabesidade
Problemas
· Cansaço
· Dificuldade de enxergar
· Formigamentos nas pernas
· Aumento da sede
· Aumento da frequência urinária
· Desempregado
· Problemas de cicatrização
· Pais diabéticos
· Tia com amputação e morte por problemas renais e cardíacos
· Glicemia de jejum alta
· Glicosúria
· Albuminuria
· Traços corpos cetônicos
· Hipertrigliceridemia
· HAS
· Aumento da circunferência abdominal
· Obesidade visceral
· Síndrome metabólica
· Problemas cardíaco
Hipóteses
· Os sintomas do paciente são indicativos de diabetes
· A situação socioeconômica e o estresse podem contribuir para os maus hábitos alimentares e consequentemente o desenvolvimento da diabetes tipo 2
· O histórico familiar é sugestivo que o diabetes tem origem genética
· O histórico do paciente associada a baixa capacidade de cicatrização é um indicativo de diabetes
· Glicosúria
· O resultado dos triglicérides indica dislipidemia
· O paciente está em risco aumentado de risco cardiovascular
· Obesidade é um risco para hipertensão
· Diabetes é fator de risco para hipertensão
· Metformina e melhoria dos hábitos alimentares tratam diabetes tipo 2
· Diabetes é fator de risco para doença cardiovascular
Questões
1 - Diferencie diabetes mellitus tipo 1 e 2 em relação a causa, manifestações clínicas e diagnósticas?
2 - Qual a prevalência e a incidência das diabetes tipo 1 e 2?
3 - Quais são os tecidos insulinodependentes e insulinoindependentes?
4 - Como é a cetoacidose diabética e como ela acontece?
5 - Quais são as causas da hiperglicemia nos tipos de diabetes?
6 - Relacione obesidade e hiperinsulinemia (come demais, libera excesso de açúcar no sangue, logo aumenta a glicemia no sangue)
7 - Relacionar a hiperinsulinemia e a resistência periférica a insulina
8 - Quais as principais consequências das diabetes a longo prazo (retinopatia, nefropatia,
9 - Compare as alterações metabólicas do jejum prolongado e da diabetes (Jejum prolongado baixa glicemia, diabetes hiperglicemia)
10 - Como é a ação do glucagon, adrenalina e cortisol na glicemia
11 - Descreva o processo da gliconeogênese hepática e renal e a importância na glicemia ou hiperglicemia?
12 - Proteólise muscular com o ciclo alanina glicose (gliconeogênese)?
13 - Qual é a relação entre a lipólise e a cetoacidose diabética?
14 - Qual é o tratamento para a diabetes tipo 1 e 2, medicamentoso e não medicamentoso?
15 - O que é síndrome metabólica (de acordo com a OMS e Associação Brasileira de Endocrinologia) e quais suas consequências?
RESPOSTAS
1 Diferencie diabetes mellitus tipo 1 e 2 em relação a causa, manifestações clínicas e diagnósticas?
Diabetes Mellitus (DM) é uma síndrome complexa, decorrente da deficiência de insulina, associada ou nāo à incapacidade desta de exercer adequadamente seus efeitos (resistência insulínica). Sua principal característica é o metabolismo anormal dos carboidratos (hiperglicemia), mas também estão comumente presentes distúrbios do metabolismo dos lipídios (dislipidemia) e das proteínas (catabolismo muscular). É importante frisar que o diabetes não é uma única doença, mas um grupo heterogêneo de distúrbios metabólicos que apresenta a hiperglicemia como característica comum.
Os 2 principais tipos do DM são:
-1- DM tipo 1 (antigamente conhecido como "diabetes juvenil" ou "diabetes insulinodependente");
-2 - DM tipo 2 (antigamente conhecido como "diabetes do adulto" ou "diabetes não insulinodependente").
O diabetes tipo 2, causa mais comum de diabetes (correspondendo a aproximadamente 90% dos casos), está associado, na maioria, a outros problemas clínicos, como hipertensão arterial, dislipidemia, excesso de peso e disfunção endotelial (síndrome metabólica), acarretando um importante aumento do risco de eventos cardiovasculares.
DM Tipo 1
O DM1 é causado pela destruição das células betapancreáticas (responsáveis pela secreção de insulina), com consequente redução da capacidade secretora de insulina e deficiência severa (em geral, absoluta) desse hormônio. Responde por 5 a 10% dos casos de DM.
a) Quadro clínico
Os pacientes são geralmente magros (embora a presença de obesidade não descarte a possibilidade de DM1) e apresentam tendência a cetoacidose. A hiperglicemia costuma ter início abrupto e atingir níveis elevados (>300mg/dL). A forma rapidamente progressiva, com instalação dos sintomas em poucos dias, quadro clínico exuberante e rápida evolução para cetoacidose, é comumente observada em crianças e adolescentes (embora também possa ocorrer em adultos). Em adultos, é mais frequentemente observada uma forma de progressão mais lenta, em que a instalação da hiperglicemia e o desenvolvimento dos sintomas são mais insidiosos (algumas semanas). Também é descrita, em adultos forma de DM1 de instalação gradual, em que o paciente pode cursar com hiperglicemia moderada, oligossintomática, inclusive com boa resposta a hipoglicemiantes orais por vários meses/anos, devido à perda mais lenta da massa de células beta. Essa forma lentamente progressiva, com quadro clínico inicial bastante semelhante ao do diabetes tipo 2, é conhecida como diabetes autoimune latente do adulto, que responde por, aproximadamente, 15% dos casos novos de DM em adultos, cuja presença é sugerida pelo aparecimento de altos títulos de autoanticorpos contra antígenos das células beta. Entretanto, com o tempo, todos, eventualmente, precisam de insulina exógena para manter a normoglicêmica e prevenir a cetoacidose.
b) Diagnóstico
O diagnóstico de DM1 é sugerido pelo início abrupto de hiperglicemia severa (geralmente, acima de 200mg/dL), habitualmente sintomática, acometendo, principalmente, crianças e jovens (embora o DM1 possa atingir qualquer faixa etária). Cerca de 70 a 80% dos casos têm início antes dos 30 anos, com pico de incidência por volta dos 12 anos. Um dado laboratorial que pode ajudar a confirmar o diagnóstico é a presença de insulinopenia severa, indicada por valores de peptídeo C <0,7mg/mL em jejum.
c) Etiologia
O DM1, em cerca de 90% dos casos, é de etiologia autoimune, com surgimento de resposta imune celular anormal contra antígenos das células beta, infiltração de linfócitos T no pâncreas e destruição citotóxica das células beta nas ilhotas de Langerhans (parte endócrina do pâncreas, que corresponde a 1% da massa do órgão). A autoimunidade, nesses casos, pode ser confirmada em laboratório pela presença de autoanticorpos dirigidos contra antígenos das células beta, como a antidescarboxilase do ácido glutâmico (anti-GAD), o anti-ilhota (ICA), a antitirosina fosfatase (anti-IA2) e a anti-insulina.
A presença de 1 ou mais desses autoanticorpos, em níveis aumentados num indivíduo diabético, define o diabetes tipo 1 autoimune, ou diabetes tipo 1A (imunomediado). O DM1A tem forte ligação com o sistema HLA (principalmente com o gene DQB) e praticamente só ocorre em portadores de HLA-DR3 e/ou DR4. Alguns alelos de HLA de alto risco para DM1A foram identificados, como o DQA1*0301 e o DQB1*0302. Da mesma forma, identificou-se o DQB1*0602 como um alelo protetor contra o desenvolvimento de DM1A.
Em alguns pacientes, entretanto (especialmente asiáticos e afrodescendentes), o DM1 pode ocorrer na ausência de autoanticorpos e sem evidência de doença autoimune. Nessa forma, a história natural é de uma doença progressiva, com hiperglicemia acentuada, tendência a cetoacidose e necessidade precoce de insulina exógena. Esses indivíduos são classificados como DM1B, ou DM1 idiopático, e respondem por cerca de 10% dos casos de DM1.
Linfócitos T que mata as células do pâncreas, não os anticorpos. Da pra rastrear os anticorpos caso tenha histórico de DM1 na família.
DM Tipo 2
DM2 é responsável pela maioria dos casos de DM (90 a 95%) e tem fisiopatologia complexa e multifatorial, com contribuição de fatores genéticos e ambientais (envelhecimento e obesidade visceral).
a) Quadro clínico
Pacientes com DM2 tipicamente apresentam um conjunto de alterações metabólicas, não restritas apenas ao metabolismo dos carboidratos, mas também envolvendo o metabolismo das lipoproteínas, fatores inflamatórios e regulação pressórica. O início é, em geral, insidioso e assintomático por longos períodos. Cerca de 60 a 90% apresentam obesidade ou acúmulo de gordura visceral e pelo menos 80% apresentam o diagnóstico de síndrome metabólica. História familiar positiva para DM é encontrada em pelo menos 50% dos pacientes com DM2.Diabéticos tipo 2 não apresentam tendência a cetoacidose como os diabéticos tipo 1, mas podem desenvolver essa complicação em situações de grande estresse (intercorrências médicas graves como choque séptico, infarto agudo do miocárdio, politraumatismo etc.).
b) Diagnóstico
O diagnóstico de DM2, na maioria dos casos, é feito a partir dos 40 anos (85 a 90% do total de casos), embora esteja ocorrendo cada vez mais frequentemente em pessoas mais jovens (especialmente obesos). Em países onde a obesidade infantil é um problema extremamente comum, como os Estados Unidos, atualmente cerca de metade dos casos de diabetes que se iniciam na adolescência é do tipo 2.
c) Fisiopatologia
A fisiopatologia envolve a resistência tecidual à ação da insulina (principalmente no fígado, no tecido musculoesquelético e no tecido adiposo) e graus variados de deficiência de secreção de insulina. Geralmente, o paciente apresenta resistência a esta por anos ou décadas antes de começar a manifestar glicemia alterada. Nessa fase, a única alteração laboratorial possível é a hiperinsulinemia compensatória.
Diagnóstico:
-Glicemia de jejum: medida da glicose no sangue venoso (soro ou plasma), após jejum de 8 a 12 horas; mais de 150mg/dl
-Teste de Tolerância a Glicose (TTG, TTOG ou GTT): após a administração (oral) de glicose anidra (75g, ou 1,75mg/kg para crianças) ou de dose equivalente de dextrose (82,5g), diluída em 250 a 300mL de água, ingerida em até 5 minutos, sendo coletado sangue para a mensuração da glicemia nos tempos zero e 120 minutos após a ingestão;
-Glicemia casual: medida de glicose no sangue venoso, colhida a qualquer momento do dia, independentemente de o paciente ter se alimentado ou não. É aceita como método diagnóstico de DM apenas em indivíduos sintomáticos, ou seja, com sintomas característicos de diabetes (perda de peso involuntária, polidipsia, poliúria etc.);
-Hemoglobina glicada (A1c): reflete a média das glicemias dos últimos 3 meses. Foi aceita como mais um método diagnóstico para DM em 2010, pelas associações europeia e norte-americana de diabetes, e em 2011 pela Sociedade Brasileira de Diabetes (SBD).
*Pela sua praticidade e pelo baixo custo, a medida da glicemia de jejum é o procedimento mais utilizado para fazer o diagnóstico de DM. A A1c, embora possa ser usada como método diagnóstico adicional, deve, preferencialmente, ser confirmada com alguma medida de glicemia, visto que a sua correlação com esta é boa, mas tem limitações. Além disso, não são todos os métodos laboratoriais para a dosagem de A1c que servem para o diagnóstico de diabetes.
O uso de tiras reagentes de glicemia capilar ou glicosúria não é adequado para o diagnóstico de DM, assim como a glicemia venosa pós-prandial não tem utilidade para esse fim.

2 - Qual a prevalência e a incidência das diabetes tipo 1 e 2?
MEDCEL
O diabetes tipo 2, causa mais comum de diabetes (correspondendo a aproximadamente 90% dos casos), está associado, na maioria, a outros problemas clínicos, como hipertensão arterial, dislipidemia, excesso de peso e disfunção endotelial (síndrome metabólica), acarretando um importante aumento do risco de eventos cardiovasculares.
Epidemiologia
Nas últimas décadas, tem ocorrido um notável aumento do número de casos de DM em todo o mundo. Em 1985, havia 30 milhões de adultos diabéticos no mundo; esse número aumentou para 120 milhões em 1997, 173 milhões em 2002, 246 milhões em 2007, 366 milhões em 2011 e 387 milhões em 2014 - a previsão é de 592 milhões por volta do ano 2035. Dois terços desses indivíduos viverão em países em desenvolvimento.
Cerca de 12 milhões de brasileiros são diabéticos. A prevalência de diabetes entre adultos brasileiros ainda não é bem estabelecida, mas deve ficar na ordem de 7,4 a 13,5%, dependendo do estudo usado como referência. Essa prevalência é ainda maior nas faixas etárias mais avançadas (17 a 21% dos indivíduos entre 60 e 69 anos). No entanto, também tem ocorrido aumento da prevalência de DM2 entre crianças e adolescentes.
Grande parte do aumento na prevalência de diabetes é devida à elevação do número de casos de diabéticos tipo 2, em paralelo à epidemia de obesidade, bem como ao envelhecimento populacional, ao sedentarismo e à urbanização. Entretanto, além do aumento do número de casos de diabetes tipo 2, as últimas décadas têm presenciado um aumento de 3% ao ano no número de casos de diabetes tipo 1 entre pessoas com menos de 15 anos (especialmente, crianças com menos de 5 anos). No Brasil, a incidência de DM1 é intermediária: em torno de 7 casos por 100.000 crianças/ano.
Um problema preocupante com relação ao diabetes tipo 2 é que 30 a 60% dos portadores da doença não sabem do seu diagnóstico, já que muitas vezes o DM é oligossintomático, ou mesmo assintomático. Além disso, boa parte dos que sabem ter a doença não faz o tratamento correto,por falta de informação ou de condições sociais ou econômicas que garantam o acompanhamento médico. Com isso, aumentam vertiginosamente os riscos de complicaçōes agudas e crônicas do DM
Biblioteca Virtual em Saúde – Ministério da Saúde
O Brasil é o 5º país em incidência de diabetes no mundo, com 16,8 milhões de doentes adultos (20 a 79 anos), perdendo apenas para China, Índia, Estados Unidos e Paquistão. A estimativa da incidência da doença em 2030 chega a 21,5 milhões. Esses dados estão no Atlas do Diabetes da Federação Internacional de Diabetes (IDF).
Mundialmente, o diabetes se tornou um sério problema de saúde pública, cujas previsões vêm sendo superadas a cada nova triagem. Por exemplo, em 2000, a estimativa global de adultos vivendo com diabetes era de 151 milhões. Em 2009, havia crescido 88%, para 285 milhões. Em 2020, calcula-se que 9,3% dos adultos, entre 20 e 79 anos (assombrosos 463 milhões de pessoas) vivem com diabetes. Além disso, 1,1 milhão de crianças e adolescentes com menos de 20 anos apresentam diabetes tipo 1.
Há uma década, em 2010, a projeção global do IDF para diabetes, em 2025, era de 438 milhões. Com mais cinco anos pela frente, essa previsão já foi ajustada para 463 milhões.
A crescente prevalência de diabetes em todo o mundo é impulsionada por uma complexa interação de fatores socioeconômicos, demográficos, ambientais e genéticos. O aumento contínuo se deve, em grande parte, ao aumento do diabetes tipo 2 e dos fatores de risco relacionados, que incluem níveis crescentes de obesidade, dietas não saudáveis e falta de atividade física. No entanto, os níveis de diabetes tipo 1, com início na infância, também estão aumentando.
Segundo o Atlas, a crescente urbanização e a mudança de hábitos de vida (por exemplo, maior ingestão de calorias, aumento do consumo de alimentos processados, estilos de vida sedentários) são fatores que contribuem para o aumento da prevalência de diabetes tipo 2 em nível social. Enquanto a prevalência global de diabetes nas áreas urbanas é de 10,8%, nas áreas rurais é menor, de 7,2%. No entanto, essa lacuna está diminuindo, com a prevalência rural aumentando.
Números de 2022
62% de indivíduos diagnosticados com DM tipo 1 estavam abaixo de 20 anos (1.52 milhões de 8.75 milhões de pessoas vivendo com DM tipo 1 no mundo em 2022)

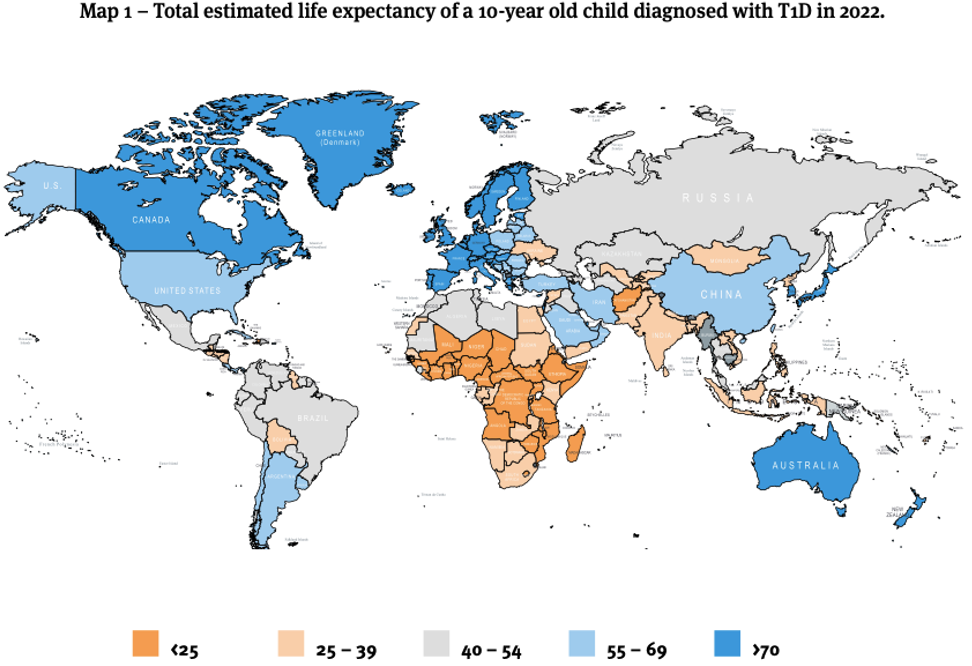
3 - Quais são os tecidos insulinodependentes e insulinoindependentes?
Insulino-independente -> Tecido renal, tecido oftálmico e tecido nervoso são insulino-independentes. Fígado, cérebro, SNC, eritrócitos e nervos não necessitam insulina para a captação de glicose
Insulino-dependentes -> Tecido muscular, adiposo, diafragma, aorta, hipófise anterior, glândulas mamárias e lente dos olhos
4 - Como é a cetoacidose diabética e como ela acontece?
Cetoacidose diabética - uma perda profunda de atividade da insulina leva não só a níveis séticos de glicose aumentados devido ao aumento do efluxo hepático de glicose e à diminuição da captação de glicose por tecidos sensíveis à insulina, mas também leva à cetogênese. Na ausência de insulina, lipólise é estimulada, fornecendo ácidos graxos que são preferencialmente convertidos em corpos cetônicos no fígado pela ação do glucagon sem oposição. Geralmente, ocorrem hiperglicemia profunda e cetose (cetoacidose diabética) nos diabéticos tipo 1, indivíduos que carecem de insulina endógena Entretanto, a cetoacidose diabética também pode acontecer no DM tipo 2, particularmente durante infecções, traumatismos graves ou outras causas de estresse que aumentam os níveis de hormônios contrarreguladores, produzindo um estado de inibição profunda da ação da insulina Hiperglicemia grave, com níveis de glicose atingindo uma média de 500 mg/dL, pode ocorrer se falhar a compensação para a diurese osmótica associada com hiperglicemia. Inicialmente, quando níveis elevados de glicose causam um aumento de osmolalidade, um desvio de água do espaço intracelular para o extracelular e o aumento da ingestão de água estimulado pela
sede ajudam a manter o volume intravascular. Se poliúria continuar e esses mecanismos compensatórios não puderem acompanhar as perdas de líquido - particularmente ingestão diminuída resultante de náusea e perdas aumentadas pelos vômitos que acompanham a cetoacidose -, a depleção de volume intra-vascular leva a fluxo sanguíneo renal diminuído. A capacidade do rim de excretar glicose é, portanto, reduzida. A hipovolemia também estimula hormônios contrarreguladores. Portanto, os níveis de glicose se elevam acentuamente devido à produção aumentada de glicose estimulada por esses hormônios e à diminuição da taxa de filtração renal, uma fonte importante de depuração de glicose na ausência de captação de glicose mediada por insulina.
Na cetoacidose diabética, o coma ocorre em uma minoria dos pacientes (10%). Hiperosmolalidade (e não acidose) é a causa do coma. Desidratação celular profunda ocorre em resposta ao aumento acentuado da osmolalidade do plasma. Uma perda acentuada de líquido intracelular no encéfalo leva ao coma. O coma acontece quando a osmolalidade efetiva do plasma atinge 330 müsm/L (normal: 280 a 295 müsm/L). Como a ureia se difunde livremente através das membranas celulares, a ureia do sangue não é usada para calcular a osmolalidade efetiva do plasma como:
O aumento de cetogênese causado por uma falta grave de ação da insulina resulta em níveis séricos aumentados de cetonas e cetonúria. Acredita-se que a insulinopenia também diminua a capacidade dos tecidos de usar cetonas, contribuindo para a manutenção de cetose. Acetoacetato e P-hidroxibutirato, os principais corpos cetônicos produzidos pelo fígado, são ácidos orgânicos e, portanto, causam acidose metabólica, diminuindo o pH do sangue e o bicarbonato sérico). A respiração é estimulada, o que compensa parcialmente a acidose metabólica por reduzir PCO2• A presença de ânions cetoácidos não mensurados na cetoacidose diabética (CAD) causa aumento no âniongap (a diferença calculada entre cátions e ânions mensurados), que em circunstâncias normais deve-se principalmente a proteínas de carga negativa, como a albumina:
Ániongap (mEq/L) = (Na++ K+)- (Cl-+ HC03- )
Quando o nível do pH é mais baixo que 7,20, ocorrem respirações rápidas, profundas, características (respiração de Kussmaul). Embora acetona seja um produto menor da cetogênese, seu odor de frutas pode ser detectado no hálito durante a cetoacidose diabética. Deve ser observado que a cetose da CAD é muito mais grave que aquela que ocorre apro- priadamente com a inanição, porque, no último caso, ação residual da insulina pode impedir lipólise excessiva e cetogênese hepática enquanto ainda permite a utilização periférica de cetonas.
Além de água, Na+é perdido durante a diurese osmótica que acompanha a cetoacidose diabética. Portanto, o Na+ corporal total é exaurido. Os níveis séricos de Na+ geralmente são baixos devido à atividade osmótica da glicose elevada, que puxa água para dentro do espaço extracelular e, dessa forma, diminui a concentração de Na+ (o Na+ sérico cai aproximadamente 1,6 mmol/L para cada 100 mg/dL de aumento da glicose).
Os estoques corporais totais de K+ também são exauridos por diurese e vômitos. Contudo, acidose, insulinopenia e níveis elevados de glicose causam um desvio de K+ para fora das células, mantendo níveis séricos de K+ normais ou mesmo elevados até que acidose e hiperglicemia sejam corrigidas. Com adminis- tração de insulina e correção da acidose, o K+ sérico cai à medida que K+ se move de volta para dentro das células. Sem tratamento, o K+ pode cair a níveis perigosamente baixos, levando a arritmias cardíacas potencialmente letais. Por isso, suplementação de K+ é administrada rotineiramente no tratamento da cetoacidose diabética. De modo semelhante, depleção de fosfato acompanha a cetoacidose diabética, embora acidose e insulinopenia possam causar a normalização dos níveis séricos de fósforo antes do tratamento. A reposição de fosfato só é fornecida em casos de depleção extrema, dados os riscos da administração de fosfato. (OfosfatointravenosopodecomplexarcomCa2+, resultando em hipocalcemia e depósito de fosfato de Ca2+em tecidos moles.)
5 - Quais são as causas da hiperglicemia nos tipos de diabetes?
A hiperglicemia também pode ser causada por alguns outros fatores, além da pouca produção de insulina. São eles:
· Dose incorreta de insulina em casos de diabetes tipo 1
· Sedentarismo alinhado ao excesso do consumo de determinados alimentos
· Estresse originado por alguma doença
· Estresse causado por fatores externos, como problemas familiares ou no trabalho, por exemplo
· Resistência do corpo à insulina, em casos de diabetes tipo 2
· “Fenômeno do Alvorecer”: ocorre em pessoas com e sem diabetes. Essa condição faz com que o nosso corpo produza uma série de hormônios todos os dias, durante a madrugada. Durante o processo, há uma reação no fígado, que faz com que o corpo libere glicose e esteja preparado para mais um dia de atividades. Consequentemente, o corpo produz menos insulina. Porém, pessoas com diabetes, não apresentam uma resposta significativa nos níveis de insulina para regular essa série de hormônios, fazendo com que a glicemia suba consideravelmente.
Diabetes Tipo 2 — Resistência aos Efeitos Metabólicos da Insulina
O diabetes tipo 2 é de longe mais comum que o tipo 1, correspondendo a cerca de 90% a 95% de todos os casos de diabetes melito. Na maioria dos casos, o início do diabetes tipo 2 ocorre depois dos 30 anos de idade, geralmente entre os 50 e 60 anos, e a evolução da doença é gradual. Portanto, a síndrome é frequentemente descrita como diabetes do adulto. Nos últimos anos, entretanto, ocorreu um aumento sistemático no número de indivíduos mais jovens, alguns com menos de 20 anos de idade, com diabetes tipo 2. Essa tendência parece estar relacionada principalmente ao aumento da prevalência da obesidade, que é o fator de risco mais importante para o diabetes tipo 2 em crianças, assim como em adultos.
Obesidade, Resistência à Insulina e “Síndrome Metabólica” geralmente Precedem o Desenvolvimento do Diabetes Tipo 2.
O diabetes tipo 2, ao contrário do tipo 1, está associado ao aumento da concentração de insulina plasmática (hiperinsulinemia). Isso acontece como resposta compensatória das células betapancreáticas à resistência à insulina, uma sensibilidade diminuída dos tecidos-alvo aos efeitos metabólicos da insulina. A redução da sensibilidade à insulina prejudica a utilização e o armazenamento dos carboidratos, elevando o nível da glicose sanguínea e estimulando o aumento compensatório da secreção de insulina.
O desenvolvimento da resistência à insulina e do metabolismo alterado da glicose é geralmente um processo gradual, começando com excesso de ganho de peso e obesidade. Os mecanismos que relacionam a obesidade à resistência insulínica, no entanto, ainda não estão bem esclarecidos. Alguns estudos sugerem que pode haver menos receptores de insulina, especialmente no músculo esquelético, no fígado e no tecido adiposo, nos indivíduos obesos do que nos de peso normal. Entretanto, a maior parte da resistência à insulina parece ser provocada por anormalidades nas vias de sinalização que ligam a ativação do receptor a diversos efeitos celulares. Alteração da sinalização da insulina parece estar intimamente relacionada aos efeitos tóxicos do acúmulo dos lipídios nos tecidos, como o músculo esquelético e fígado, em consequência do ganho excessivo de peso.
A resistência insulínica faz parte de uma cascata de distúrbios que frequentemente é chamada “síndrome metabólica”. Algumas das características da síndrome metabólica incluem: (1) obesidade, especialmente acúmulo de gordura abdominal; (2) resistência à insulina; (3) hiperglicemia de jejum; (4) anormalidades lipídicas, tais como aumento dos triglicerídeos no sangue e redução da lipoproteína de alta
densidade; e (5) hipertensão. Todas as características da síndrome metabólica estão intimamente relacionadas com o acúmulo do excesso de tecido adiposo na cavidade abdominal em torno das vísceras.
O papel da resistência insulínica que contribui com alguns dos componentes da síndrome metabólica ainda não foi bem esclarecido, apesar de estar claro que a resistência à insulina é a causa primária do aumento da concentração da glicose no sangue. A principal consequência negativa da síndrome metabólica é a doença cardiovascular, incluindo aterosclerose e lesões em diversos órgãos do corpo. Várias das anormalidades metabólicas, associadas a essa síndrome, aumentam o risco de doença cardiovascular, e a resistência à insulina predispõe ao desenvolvimento de diabetes melito tipo 2, que é também importante causa de doença cardiovascular.
Outros Fatores Capazes de Provocar Resistência Insulínica e Diabetes Tipo 2
Embora a maioria dos pacientes portadores de diabetes tipo 2 esteja com excesso de peso ou apresente acúmulo substancial de gordura visceral, grave resistência à insulina e diabetes tipo 2 também podem ocorrer como resultado de outras condições genéticas ou adquiridas que prejudicam a sinalização da insulina nos tecidos periféricos (Tabela 79-2).
A síndrome do ovário policístico (PCOS), por exemplo, está associada aos aumentos acentuados da produção de androgênios ovarianos e resistência à insulina. É um dos distúrbios endócrinos mais comuns em mulheres, acometendo aproximadamente 6% de todas as mulheres durante sua vida reprodutiva. Embora a patogênese da PCOS continue pouco elucidada, a resistência insulínica e a hiperinsulinemia são encontradas em torno de 80% das mulheres afetadas. As consequências em longo prazo incluem maior risco de diabetes melito, de aumento da concentração dos lipídios sanguíneos e doença cardiovascular.
A formação excessiva de glicocorticoides (síndrome de Cushing) ou de hormônio do crescimento (acromegalia) também diminui a sensibilidade de diversos tecidos aos efeitos metabólicos da insulina e pode levar ao desenvolvimento de diabetes melito. As causas genéticas da obesidade e da resistência insulínica, se forem bastante graves, também podem dar origem ao diabetes tipo 2, assim como a muitas outras características da síndrome metabólica, incluindo a doença cardiovascular.

Desenvolvimento do Diabetes Tipo 2 Durante Prolongada Resistência à Insulina
Nos casos de resistência insulínica prolongada e grave, até mesmo níveis aumentados de insulina não são suficientes para manter a regulação normal da glicose. Como consequência, vamos encontrar hiperglicemia moderada, após a ingestão de carboidratos, nos estágios iniciais da doença.
Nos estágios mais avançados do diabetes tipo 2, as células betapancreáticas tornam-se “exauridas” ou lesadas e são incapazes de produzir insulina suficiente para impedir hiperglicemia mais grave, em especial depois de a pessoa ingerir refeição rica em carboidratos.
Algumas pessoas obesas, apesar de apresentarem acentuada resistência à insulina e aumentos acima do normal de glicose sanguínea após uma refeição, nunca desenvolvem diabetes melito clinicamente significativo; aparentemente, o pâncreas, nessas pessoas, produz insulina suficiente para impedir anormalidades graves do metabolismo da glicose. No entanto, em outras pessoas obesas, o pâncreas gradativamente se esgota por secretar grandes quantidades de insulina ou fica prejudicado por fatores associados ao acúmulo de lipídios no pâncreas, e se instala o diabetes melito completo. Alguns estudos sugerem que fatores genéticos desempenham papel importante na determinação da capacidade do pâncreas da pessoa de manter o débito elevado da insulina durante o período de longos anos, necessário para evitar as graves anormalidades do metabolismo da glicose no diabetes tipo 2.
Em muitas circunstâncias, o diabetes tipo 2 pode ser tratado eficazmente pelo menos nos estágios iniciais, com exercícios, restrição calórica e redução de peso, sem necessidade da administração exógena de insulina. Os fármacos que aumentam a sensibilidade à insulina, tais como as tiazolidinedionas, fármacos que suprimem a produção de glicose no fígado, como a metformina, ou fármacos que provocam liberação adicional da insulina pelo pâncreas, tais como as sulfonilureias, também podem ser empregados. No entanto, nos estágios mais avançados do diabetes tipo 2, a administração de insulina é, geralmente, necessária para controlar a glicemia.
Foram desenvolvidos fármacos que simulam as ações da incretina GLP-1 para o tratamento do diabetes tipo 2. Esses fármacos favorecem a secreção de insulina e estão destinados a ser utilizados conjuntamente com outros antidiabéticos. Outro enfoque terapêutico consiste em inibir a enzima dipeptidil peptidase 4 (DPP-4), que inativa os hormônios GLP-1 e GIP. Ao bloquear as ações da DPP-4, os efeitos das
incretinas GLP-1 e GIP podem ser prolongados, conduzindo a uma elevação da secreção de insulina e a um melhor controle dos níveis sanguíneos de glicose.
6 - Relacione obesidade e hiperinsulinemia
O tecido adiposo é muito sensível à ação da insulina, portanto, a atividade baixa de insulina é capaz de suprimir a lipólise excessiva e aumentar o armazenamento de gordura. Níveis mais altos de insulina são necessários para se opor aos efeitos do glucagon no fígado e bloquear o efluxo hepático de glicose. Em indivíduos normais, níveis basais de atividade da insulina são capazes de mediar ambas as respostas, sendo o fígado, em particular, muito responsivo a mudanças na secreção pancreática de insulina devido à sua alta sensibilidade e exposição a níveis elevados de insulina na circulação portal. Entretanto, a capacidade do músculo esquelético de responder a uma carga de glicose com captação de glicose mediada por insulina requer a
secreção estimulada de insulina adicional pelo pâncreas. Portanto, deficiências leves da ação de insulina são frequentemente manifestadas por uma incapacidade de tecidos sensíveis à insulina (p. ex., músculo esquelético que é responsável por 85% da depuração pós-prandial de glicose) de eliminar sobrecargas de glicose. Clinicamente, isso resulta em hiperglicemia pós-prandial (Figura 18-7). Tais indivíduos, mais comumente diabéticos tipo 2 com secreção residual de insulina, terão resultados anormais do teste oral de tolerância à glicose e/ou níveis altos de glicose pós-prandiais. Entretanto, os níveis de glicose em jejum permanecem normais, porque está presente ação da insulina suficiente para contrabalançar o efluxo hepático de glicose mediado por glucagon que os mantém. Quando ocorre uma perda adicional de ação da insulina, os efeitos do glucagon no fígado não são contrabalançados suficientemente. Os indivíduos, portanto, apresentam tanto hiperglicemia pós-prandial quanto hiperglicemia em jejum
Obesidade, Resistência à Insulina e “Síndrome Metabólica” geralmente Precedem o Desenvolvimento do Diabetes Tipo 2.
O diabetes tipo 2, ao contrário do tipo 1, está associado ao aumento da concentração de insulina plasmática (hiperinsulinemia). Isso acontece como resposta compensatória das células betapancreáticas à resistência à insulina, uma sensibilidade diminuída dos tecidos-alvo aos efeitos metabólicos da insulina. A redução da sensibilidade à insulina prejudica a utilização e o armazenamento dos carboidratos, elevando o nível da glicose sanguínea e estimulando o aumento compensatório da secreção de insulina.
O desenvolvimento da resistência à insulina e do metabolismo alterado da glicose é geralmente um processo gradual, começando com excesso de ganho de peso e obesidade. Os mecanismos que relacionam a obesidade à resistência insulínica, no entanto, ainda não estão bem esclarecidos. Alguns estudos sugerem que pode haver menos receptores de insulina, especialmente no músculo esquelético, no fígado e no tecido adiposo, nos indivíduos obesos do que nos de peso normal. Entretanto, a maior parte da resistência à insulina parece ser provocada por anormalidades nas vias de sinalização que ligam a ativação do receptor a diversos efeitos celulares. Alteração da sinalização da insulina parece estar intimamente relacionada aos efeitos tóxicos do acúmulo dos lipídios nos tecidos, como o músculo esquelético e fígado, em consequência do ganho excessivo de peso.
A resistência insulínica faz parte de uma cascata de distúrbios que frequentemente é chamada “síndrome metabólica”. Algumas das características da síndrome metabólica incluem: (1) obesidade, especialmente acúmulo de gordura abdominal; (2) resistência à insulina; (3) hiperglicemia de jejum; (4) anormalidades lipídicas, tais como aumento dos triglicerídeos no sangue e redução da lipoproteína de alta
densidade; e (5) hipertensão. Todas as características da síndrome metabólica estão intimamente relacionadas com o acúmulo do excesso de tecido adiposo na cavidade abdominal em torno das vísceras.
O papel da resistência insulínica que contribui com alguns dos componentes da síndrome metabólica ainda não foi bem esclarecido, apesar de estar claro que a resistência à insulina é a causa primária do aumento da concentração da glicose no sangue. A principal consequência negativa da síndrome metabólica é a doença cardiovascular, incluindo aterosclerose e lesões em diversos órgãos do corpo. Várias das anormalidades metabólicas, associadas a essa síndrome, aumentam o risco de doença cardiovascular, e a resistência à insulina predispõe ao desenvolvimento de diabetes melito tipo 2, que é também importante causa de doença cardiovascular.
7 - Relacionar a hiperinsulinemia e a resistência periférica a insulina
Há uma incidência mais alta de resistência à insulina, hiperinsulinemia, hiperlipidemia e obesidade em pacientes com hipertensão essencial e em seus parentes normotensos do que na população geral, ou em pacientes com hipertensão por causas conhecidas. Esta combinação de anormalidades é às vezes chamada de síndrome metabólica (anteriormente denominada síndrome X). Há especulação de que a resistência à insulina causa secreção de insulina aumentada e que a hiperinsulinemia resultante estimula o sistema nervoso simpático, causando hipertensão. Contudo, a correlação não prova causa e efeito, e pacientes com tumores pancreáticos secretores de insulina (insulinomas) não têm uma incidência aumentada de hipertensão. Além disso, em cães e seres humanos normais, infusões prolongadas de insulina têm um leve efeito vasodilatador em vez de vasoconstritor, e em um estudo cuidadoso de pacientes obesos com hipertensão essencial, a infusão prolongada de insulina causou uma pequena diminuição em vez de um aumento da pressão arterial. Assim, embora a causa de resistência à insulina, hiperinsulinemia, obesidade e hiperlipidemia na hipertensão permaneça indefinida, parece improvável que resistência à insulina aumentada seja uma causa importante de hipertensão essencial.
8 - Quais as principais consequências das diabetes a longo prazo
As principais complicações agudas da DM são:
· Hipoglicemia diabética -> Principalmente entre pacientes que usam secretagogos ou insulina. Déficit progressivo na liberação de glucagon e mais tardiamente de catecolaminas.
· Cetoacidose diabética -> aumento da lipólise, aumento da oferta de ácidos graxos livres ao fígado e consequentemente da cetogênese hepática, gerando corpos cetônicos ácidos que levam a acidose.
· Estado hiperosmolar hiperglicêmico -> tem um pouco de insulina que impede a lipólise e a síntese hepática de corpos cetônicos, logo não entra em CAD mas não mantém glicemia normal. Há hiperglicemia, glicosúria, diurese osmótica, depleção de volume, hiperosmolaridade e distúrbios hidroeletrolíticos por perda urinária de eletrólitos, o que leva a desidratação e hiperosmolaridade intensa (rebaixamento de consciência (torpor/coma) e insuficiência renal aguda.
As principais consequências crônicas da DM são:
· Retinopatia diabética -> Microaneurismas, edema ou exsudatos oculares – extravasamento de substância lipídicas pela alteração da permeabilidade tecidual. Principal causa de cegueira em adultos.
· Doença renal do diabetes (anteriormente chamada de Nefropatia diabética) -> insuficiência renal causada pelo aumento da pressão interglomerular por contra principalmente da albuminúria (aumenta também o risco cardiovascular), hiperglicemia e hipertensão arterial (tabela 7). Aumento da EUA/Microabuminúria é o marcador inicial, junto a creatinina sérica.
· Neuropatia diabética -> Comprometimento do sistema nervoso somático ou/e autonômico com uma ampla gama de apresentações e sintomas, sendo o mais comum a polineuropatia simétrica distal. (tabela 11)
· Pé diabético -> Complicação da neuropatia diabética formando uma úlcera neuropática por conta da perda da sensibilidade protetora dos pés (60% dos casos), da associação de neuropatia e isquemia (30% dos casos) ou apenas da isquemia (10% dos casos). Tem risco 17x maior de amputação. Teste do monofilamento de 10g.
· Aterosclerose e doenças cardiovasculares (incluindo infarto, avc e gangrena) -> Principal causa de morte em diabéticos, causada por conta da disfunção endotelial, hiperagrebilidade plaquetária, anormalidade da coagulação e microalbuminúria. Morte súbita por infarto silencioso por conta de denervação cardíaca. Hipercolesterolemia no diabético é problemática pois junto a HAS vai gerar placas de ateroma e pode formar trombos ou embolos.
· Hipertensão arterial sistêmica -> Observada em pelo menos 70% de indivíduos com DM tipo 2 (40% já no diagnostico de DM)
· Estado inflamatório sistêmico crônico -> PCR alto
· Infecção -> Quimiotaxia de neutrófilos e fagocitose são deficientes no diabetes malcontrolado. A imunidade celular também pode ser anormal. Além disso, lesões vasculares podem prejudicar o fluxo de sangue, impedindo que células inflamatórias formem feridas. Portanto, indivíduos com diabetes são mais propensos a desenvolver infecções e podem ter infecções mais graves.
· Alterações esqueléticas no diabetes -> Crianças com DM tipo 1 têm uma massa óssea muito inferior, atribuída à perda dos efeitos anabólicos da insulina sobre os ossos que estimulam a diferenciação de osteoblastos formadores de osso, e um aumento associado de fraturas por fragilidade óssea. Adultos com DM tipo 2 têm um risco aumentado de fraturas, talvez devido a alterações sutis da microarquitetura (porosidade cortical aumentada).


9 - Compare as alterações metabólicas do jejum prolongado e da diabetes (Jejum prolongado baixa glicemia, diabetes hiperglicemia)
No jejum prolongado
Após um jejum noturno, o fígado desempenha um papel primário na manutenção da glicemia ao produzir glicose na mesma proporção em que ela é utilizada pelos tecidos em repouso. A captação e utilização de glicose ocorrem predominantemente em tecidos que não requerem insulina para captação de glicose, como o encéfalo. O efluxo hepático de glicose é estimulado por glucagon e é devido, principalmente, à glicogenólise, que pode fornecer, em média, um suprimento de glicose de 8 horas. Os baixos níveis de insulina que estão presentes (secreção basal de 0,25 a 1,0 unidade/h) são insuficientes para bloquear a liberação de ácidos graxos da gordura, que provê energia para músculos (oxidação de ácidos graxos) e substrato para cetogênese hepática. Entretanto, esses níveis de insulina são suficientes para impedir lipólise excessiva, cetogênese e gliconeogênese, prevenindo hiperglicemia e cetoacidose.
Em decorrência de jejum prolongado, (> 24 a 60 horas), os estoques de glicogênio no fígado são exauridos. Os níveis de glucagon se elevam levemente, e os níveis de insulina declinam ainda mais. A gliconeogênese torna-se então a única fonte de produção hepática de glicose, usando substratos como aminoácidos que são mobilizados da periferia em uma proporção maior. Devido à inanição, ocorre uma troca no fígado de gliconeogênese para produção de cetonas, uma fonte alternativa de energia que fornece 90% da energia usada pelo encéfalo, um órgão essencial que é responsável por 25% das necessidades metabólicas basais de energia. Dessa maneira, a sobrevida é prolongada quando a proteína do músculo é conservada em favor do aumento da mobilização de ácidos graxos do tecido adiposo, um processo possível pela insulinopenia aumentada. O fígado então converte ácidos graxos em corpos cetônicos, um processo que é estimulado por glucagon. Devido ao jejum prolongado ou à inanição, o rim também começa a contribuir significativamente para gliconeogênese.
Cetose durante o Diabetes
As concentrações de ácido acetoacético, ácido b-hidroxibutírico e acetona ocasionalmente aumentam para níveis muito superiores ao normal, no sangue e nos líquidos intersticiais; essa condição é chamada cetose, porque o ácido acetoacético é cetoácido. Na diabetes isso ocorre por não existir insulina disponível para promover o transporte da glicose para as células. Quando os carboidratos não são utilizados como energia, quase toda a energia do corpo deve derivar do metabolismo das gorduras.
A indisponibilidade dos carboidratos automaticamente aumenta a intensidade da retirada dos ácidos graxos dos tecidos adiposos. Além disso, diversos fatores hormonais — tais como o aumento da secreção dos glicocorticoides pelo córtex adrenal, aumento da secreção do glucagon pelo pâncreas e diminuição da secreção da insulina pelo pâncreas — aumentam ainda mais a remoção dos ácidos graxos dos tecidos adiposos. Como consequência, grande quantidade de ácidos graxos fica disponível (1) para as células dos tecidos periféricos, para seu emprego como fonte de energia; e (2) para as células hepáticas, onde grande parte dos ácidos graxos é transformada em corpos cetônicos.
Os corpos cetônicos saem do fígado de modo a serem levados até as células. Por diversas razões, as células são limitadas na quantidade de corpos cetônicos que podem oxidar. A limitação mais importante é que um dos produtos do metabolismo dos carboidratos é o oxaloacetato necessário para a ligação com a acetil-CoA, antes que possa ser processado no ciclo do ácido cítrico. Logo, a deficiência de oxaloacetato derivado dos carboidratos limita a entrada da acetil-CoA no ciclo do ácido cítrico e, quando existe expansão simultânea de grande quantidade de ácido acetoacético e de outros corpos cetônicos do fígado, as concentrações séricas de ácido acetoacético e de ácido b-hidroxibutírico, às vezes, sobem até 20 vezes de seu valor normal, levando, assim, à acidose extrema.
A acetona que se forma durante a cetose é substância volátil, parte da qual é eliminada em pequenas quantidades no ar expirado pelos pulmões, dando lugar a um hálito cetônico que é frequentemente usado como critério para o diagnóstico da cetose.
Glicemia do diabético vai estar alta, no indivíduo em jejum vai estar baixa.
10 – Como é a ação do glucagon, adrenalina e cortisol na glicemia
GLUCAGON
Síntese e metabolismo
O glucagon, um peptídeo de 29 aminoácidos, é produzido em células a do pâncreas pelo processamento proteolítico do pró-glucagon, uma proteína precursora maior. Além do pâncreas, o pró-glucagon também é expresso no intestino e no encéfalo. Enquanto o glucagon é o principal metabólito bioativo
produzido na célula a pancreática, o processamento diferencial por células L no intestino resulta na produção de peptídeo semelhante a glucagon (GLP)-1 e GLP-2 em resposta a uma refeição (Figura 18-5). Esse processamento tecido-específico resulta em peptídeos com efeitos opostos no metabolismo de carboidratos; o glucagon pancreático é contraposto aos efeitos hepáticos da insulina, ao passo que os GLPs atuam como incretinas, peptídeos derivados do intestino que aumentam a secreção de insulina glicose-estimulada. A meia-vida circulante do glucagon é de 3 a 6 minutos. Como a insulina, o glucagon é metabolizado no fígado e nos rins, e estes, em vez do fígado, desempenham um papel significativo. Análogos de ação prolongada do GLP-1, que também estimulam a proliferação de células beta e aumentam a massa dessas células, ou inibidores de enzimas que estendem a meia-vida de GLP-1 endógeno representam uma classe de fármacos mais novos e importantes usados no tratamento de diabetes melito tipo 2.
Regulação da secreção
Ao contrário da estimulação da secreção de insulina pela glicose, a secreção de glucagon é inibida por glicose (Tabela 18-1). Entretanto, a importância relativa do sensoriamento direto de glicose pela célula a versus efeitos indiretos parácrinos/endócrinos de outros fatores pancreáticos na regulação da secreção de glucagon é objeto de debate. Evidências atuais sugerem que a insulina desempenha um papel importante na modulação (i.e., inibição) da secreção de glucagon. Além disso, a perda dos efeitos supressores da insulina pancreática aumentada no diabetes em resposta à hiperglicemia resulta em um nível inapropriadamente alto de glucagon, que contribui para a hiperglicemia do diabetes melito. Outros fatores pancreáticos que inibem a secreção de glucagon incluem a somatostatina e dois produtos secretores adicionais das células (3, ácido-y-aminobutírico (GABA) e zinco insulina-associado. Como a insulina, a secreção de glucagon é estimulada por aminoácidos, um aspecto regulador importante no metabolismo de refeições de proteína. Em contrapartida, ácidos graxos e cetonas inibem a secreção de glucagon. Outros hormônios contrarreguladores, como catecolaminas (por meio de um efeito (3-adrenérgico predominante) e cortisol, estimulam a liberação de glucagon.
Mecanismo de ação
O principal papel biológico do glucagon é manter níveis normais de glicose durante o jejum pela indução da produção hepática de glicose, contrabalançando, assim, os efeitos hepáticos da insulina. Portanto, o fígado é o principal órgão-alvo para ação do glucagon. O glucagon liga-se a um receptor de glucagon acoplado à proteína G presente na superfície celular de hepatócitos, ativando adenilato-ciclase e gerando AMPc. O AMP cíclico ativa proteína-quinase A, que ativa a transcrição gênica para as enzimas responsáveis pela atividade biológica do glucagon no fígado e, subsequentemente, fosforila e ativa essas mesmas enzimas. Há também alguma evidência de que o receptor de glucagon possa agir por meio de um mecanismo independente de adenilato-ciclase por estimulação da fosfolipase c.
Efeitos
As ações do glucagon foram demonstradas primeiramente em 1921 por Banting e Best, quando eles observaram uma hiperglicemia leve transitória precedendo a hipoglicemia induzida por insulina ao testar extratos pancreáticos in vivo. O glucagon é um hormônio contrarregulador, agindo de modo catabólico para se opor aos efeitos da insulina. De fato, injeções de glucagon são usadas clinicamente para tratar hipoglicemia grave.
Os efeitos hepáticos do glucagon (Tabela 18-2) incluem os seguintes: (1) efluxo hepático de glicose aumentado por meio da liberação de estoques de glicose (glicogenólise) e, em conjunto com outros hormônios contrarreguladores, estimulação da síntese hepática de glicose (gliconeogênese); (2) captação hepática de aminoácidos aumentada, o que serve de energia para a gliconeogênese; e (3) estimulação da oxidação de ácidos graxos e cetogênese, fornecendo energia alternativa (corpos cetônicos) que pode ser usada pelo encéfalo quando glicose não está disponível. O significado fisiológico de receptores de glucagon em tecido não hepático (do rim, adiposo, do pâncreas) é menos certo. Por exemplo, o glucagon, embora menos potente, compartilha com GLP-1 a capacidade de aumentar a secreção de insulina por células (3 glicose-induzida.)
Condições de estresse
Durante o estresse intenso, quando o aporte de energia ao encéfalo está em risco, hormônios contrarreguladores, além do glucagon, agem de forma sinérgica. Eles mantêm os níveis de glicemia por maximizar o efluxo hepático de glicose e a mobilização periférica de substratos e minimizar o armazenamento de energia. Glucagon e adrenalina levam minutos para elevar a glicemia, enquanto os efeitos contrarreguladores de cortisol e hormônio do crescimento levam várias horas. Adrenalina, cortisol e hormônio do crescimento estimulam a liberação de glucagon, enquanto a adrenalina inibe insulina, aumentando, assim, de forma máxima, a razão glucagon-insulina. Além disso, esses três hormônios agem diretamente sobre o fígado para aumentar a produção hepática de glicose, e perifericamente para estimular lipólise e inibir a captação de glicose sensível à insulina. Durante o estresse intenso, a hiperglicemia pode, na verdade, resultar dos efeitos combinados de hormônios contrarreguladores.
Efeitos semelhantes, porém, menos acentuados, ocorrem em resposta ao exercício, quando glucagon, catecolaminas e, em grau menor, cortisol, ajudam a satisfazer o aumento muito
superior das taxas de utilização de glicose devido aos músculos em exercício, efeitos que se tornam possíveis pelo aumento
Efeitos do cortisol no metabolismo de carboidratos
Estímulo da Gliconeogênese. O efeito metabólico mais bem conhecido do cortisol e de outros glicocorticoides é sua capacidade de estimular a gliconeogênese (i. e., a formação de carboidratos a partir de proteínas e algumas outras substâncias) pelo fígado, cuja atividade, frequentemente, aumenta de 6 a 10 vezes. Esse aumento do ritmo da gliconeogênese resulta,
principalmente, dos efeitos diretos do cortisol no fígado, bem como da antagonização dos efeitos da insulina.
1. O cortisol aumenta as enzimas necessárias para a conversão de aminoácidos em glicose pelas células hepáticas. Isso resulta do efeito dos glicocorticoides na ativação da transcrição de DNA nos núcleos das células hepáticas, ação semelhante à da aldosterona nas células tubulares renais, com a formação de mRNA, que, por sua vez, geram o conjunto de enzimas necessárias para a gliconeogênese.
2. O cortisol provoca a mobilização de aminoácidos a partir dos tecidos extra-hepáticos, principalmente dos músculos. Como resultado, mais aminoácidos são disponibilizados no plasma para entrar no processo de gliconeogênese pelo fígado e, assim, promover a formação de glicose.
3. O cortisol antagoniza os efeitos da insulina para inibir a gliconeogênese no fígado. Tal como discutido no Capítulo 79, a insulina estimula a síntese de glicogênio no fígado e inibe as enzimas envolvidas na produção de glicose pelo fígado. O efeito global do cortisol é o aumento na produção de glicose pelo fígado.
A elevação acentuada das reservas de glicogênio nas células hepáticas, que acompanha o aumento da gliconeogênese, potencializa os efeitos de outros hormônios glicolíticos, tais como epinefrina e glucagon, para mobilizer a glicose em momentos de necessidade, como entre as refeições.
Redução da Utilização Celular de Glicose. O cortisol também provoca redução moderada da utilização de glicose pela maior parte das células do organismo. Embora a causa exata dessa redução não seja conhecida, um efeito importante do cortisol é a diminuição da translocação dos transportadores de glicose GLUT 4 para a membrana celular, em especial nas células do músculo esquelético, o que conduz à resistência à insulina. Os glicocorticoides também podem deprimir a expressão e a fosforilação de outras cascatas de sinalização que influenciam a utilização de glicose, direta
ou indiretamente, ao afetar o metabolismo das proteínas e dos lipídios. Por exemplo, os glicocorticoides têm sido implicados na redução da expressão do substrato do receptor de insulina 1 e fosfatidilinositol 3 cinase, ambos os quais estão envolvidos na mediação das ações de insulina, bem como na oxidação de nicotinamida adenina dinucleotídeo (NADH) para a formação de NAD+. Como é necessária a oxidação de NADH para permitir a glicólise, esse efeito também contribui para a redução da utilização de glicose pelas células.
Elevação da Concentração Sanguínea de Glicose e “Diabetes Adrenal”. Tanto o aumento da gliconeogênese quanto a redução moderada da velocidade de utilização da glicose pelas células provocam a elevação da concentração sanguínea de glicose. Essa elevação, por sua vez, estimula a secreção de insulina. Os maiores níveis plasmáticos de insulina, entretanto, não são tão efetivos na manutenção da glicose plasmática como em condições normais. Pelos motivos discutidos anteriormente, os altos níveis de glicocorticoides reduzem a sensibilidade de muitos tecidos, especialmente do músculo esquelético e tecido adiposo, aos efeitos estimulantes da insulina na captação e utilização da glicose. Além dos possíveis efeitos diretos do cortisol na expressão dos transportadores de glicose e nas enzimas envolvidas na regulação da glicose, os altos níveis de ácidos graxos, causados pelo efeito dos glicocorticoides na mobilização de lipídios a partir dos depósitos de gordura, podem prejudicar as ações da insulina nos tecidos. Dessa maneira, o excesso da secreção de glicocorticoides pode produzir distúrbios no metabolismo de carboidratos muito semelhantes aos notados em pacientes com níveis excessivos de hormônio do crescimento.
Em alguns casos, o aumento da concentração sanguínea de glicose é tão grande (50% ou mais acima do normal), que a condição é chamada diabetes adrenal. A administração de insulina reduz apenas moderadamente a concentração sanguínea de glicose no diabetes adrenal — muito menos que no diabetes pancreático — porque os tecidos ficam resistentes aos efeitos da insulina.
Efeitos do cortisol no metabolismo das proteínas
Redução das Proteínas Celulares. Um dos principais efeitos do cortisol nos sistemas metabólicos do organismo é a redução dos depósitos de proteínas em, praticamente, todas as células corporais, exceto no fígado. Essa redução é causada tanto pela diminuição da síntese de proteínas como pelo aumento do catabolismo das proteínas já presentes nas células. Ambos os efeitos podem resultar, parcialmente, da redução do transporte de aminoácidos para os tecidos extra-hepáticos, como discutido antes; entretanto, essa não é, provavelmente, a principal causa, porque o cortisol também reduz a formação de RNA e a subsequente síntese proteica em muitos tecidos extra-hepáticos, especialmente nos músculos e tecidos linfoides.
Na presença de grande excesso de cortisol, os músculos podem ficar tão fracos, que o indivíduo não consegue se levantar da posição agachada. Além disso, as funções imunológicas dos tecidos linfoides podem ser reduzidas até apenas uma fração do normal.
O Cortisol Aumenta as Concentrações Plasmáticas e Hepáticas de Proteínas. Ao mesmo tempo em que os efeitos dos glicocorticoides reduzem as proteínas nas demais partes do corpo, as proteínas hepáticas são aumentadas. Além disso, as proteínas plasmáticas (produzidas pelo fígado e, então, liberadas para a circulação) também se elevam. Esses aumentos são exceções à depleção de proteínas que ocorre em todas as demais partes do corpo. Acredita-se que essa diferença resulte de possível efeito do cortisol para estimular o transporte de aminoácidos para as
células hepáticas (mas não para a maioria das outras células) e a produção de enzimas hepáticas necessárias para a síntese proteica.
Aumento dos Aminoácidos Sanguíneos, Redução do Transporte de Aminoácidos para as Células Extra-hepáticas e Elevação do Transporte para Células Hepáticas. Estudos em tecidos isolados demonstraram que o cortisol reduz o transporte de aminoácidos para as células musculares e, talvez, para outras células extra- hepáticas.
O transporte reduzido de aminoácidos para as células extra-hepáticas diminui suas concentrações intracelulares e, consequentemente, a síntese proteica. Entretanto, o catabolismo proteico nas células continua a liberar aminoácidos que se difundem para fora das células, aumentando a concentração plasmática de aminoácidos. Portanto, o cortisol mobiliza aminoácidos nos tecidos não hepáticos e, dessa forma, reduz as reservas teciduais de proteínas.
Uma maior concentração plasmática de aminoácidos e seu transporte aumentado para as células hepáticas pelo cortisol também poderiam ser responsáveis pela utilização melhorada de aminoácidos pelo fígado, causando efeitos como (1) maior desaminação de aminoácidos pelo fígado; (2) aumento da síntese proteica no fígado; (3) formação maior de proteínas plasmáticas pelo fígado; e (4) aumento da conversão de aminoácidos em glicose — isto é, da gliconeogênese. Assim, é possível que muitos dos efeitos do cortisol nos sistemas metabólicos do organismo resultem, principalmente, de sua capacidade de mobilizar aminoácidos dos tecidos periféricos, ao mesmo tempo em que aumenta as enzimas necessárias para os efeitos hepáticos.
Efeitos do cortisol no metabolismo da gordura
Mobilização de Ácidos Graxos. Quase da mesma maneira como promove a mobilização de aminoácidos dos músculos, o cortisol mobiliza os ácidos graxos do tecido adiposo. Essa mobilização eleva a concentração de ácidos graxos livres no plasma, o que também aumenta sua utilização para a geração de energia. O cortisol também parece exercer efeito direto no aumento da oxidação de ácidos graxos nas células.
O mecanismo pelo qual o cortisol promove a mobilização de ácidos graxos não é completamente compreendido. Entretanto, parte do efeito, provavelmente, resulta do transporte menor de glicose para as células adiposas. Lembre-se que o a-glicerofosfato derivado da glicose é necessário para a deposição e manutenção de triglicerídeos nessas células. Em sua ausência, as células adiposas começam a liberar ácidos graxos.
A elevada mobilização de gorduras pelo cortisol, combinada à maior oxidação de ácidos graxos nas células, contribui para que os sistemas metabólicos celulares deixem de utilizar glicose para a geração de energia e passem a utilizar ácidos graxos em momentos de jejum ou outros estresses. Esse mecanismo do cortisol, entretanto, precisa de muitas horas para ficar plenamente funcional — seu resultado não é tão rápido nem tão potente quanto o efeito semelhante provocado por diminuição da insulina. Contudo, o amplo uso de ácidos graxos para a geração metabólica de energia é fator importante para a conservação, em longo prazo, da glicose e do glicogênio corporais.
11 - Descreva o processo da gliconeogênese hepática e renal e a importância na glicemia ou hiperglicemia?
Formação de Carboidratos a partir de Proteínas e Gorduras — Gliconeogênese
Quando as reservas de carboidratos do organismo caem abaixo da normal, quantidades moderadas de glicose podem ser formadas a partir de aminoácidos e da porção glicerol dos lipídios. Esse processo é chamado gliconeogênese.
A gliconeogênese é especialmente importante na prevenção de redução excessiva da concentração de glicose no sangue durante o jejum. A glicose é o substrato primário de energia, em tecidos como o cérebro e as hemácias, e quantidades adequadas de glicose devem estar presentes no sangue por diversas horas, entre as
refeições. O fígado desempenha papel fundamental na manutenção dos níveis de glicose sanguínea durante o jejum ao converter seu glicogênio armazenado em glicose (glicogenólise) e ao sintetizar a glicose, principalmente a partir do lactato e de aminoácidos (gliconeogênese). Aproximadamente 25% da produção de glicose hepática deriva da gliconeogênese, ajudando a manter o fornecimento estável de glicose para o cérebro. Durante jejum prolongado, os rins também sintetizam quantidades consideráveis de glicose, a partir de aminoácidos e de outros precursores.
Cerca de 60% dos aminoácidos nas proteínas do corpo podem ser facilmente convertidos em carboidratos; os restantes 40% apresentam configurações químicas que dificultam ou impossibilitam essa conversão. Cada aminoácido é convertido em glicose por meio de processo químico ligeiramente diferente. Por exemplo, a alanina pode ser convertida direto em ácido pirúvico, simplesmente pela desaminação; o ácido pirúvico é então convertido em glicose ou glicogênio armazenado. Diversos dos aminoácidos mais complicados podem ser convertidos em açúcares diferentes, contendo três, quatro, cinco ou sete átomos de carbono; eles podem então entrar na via do fosfogluconato e, eventualmente, formar glicose. Assim, por meio da desaminação com diversas interconversões simples, muitos dos aminoácidos podem tornar-se glicose. Interconversões similares podem transformar o glicerol, em glicose ou em glicogênio.
Gliconeogênese Renal
Durante o jejum prolongado, os rins sintetizam glicose a partir de aminoácidos e outros precursores, processo conhecido como gliconeogênese. A capacidade dos rins de adicionar glicose ao sangue, durante períodos prolongados de jejum, equivale à do fígado.
Na doença renal crônica ou na insuficiência renal aguda, essas funções de manutenção da homeostasia são interrompidas e rapidamente ocorrem
anormalidades graves dos volumes e da composição do líquido corporal. Com a insuficiência renal total, potássio, ácidos, líquidos e outras substâncias se acumulam no corpo, causando a morte em poucos dias, a não ser que intervenções clínicas, como a hemodiálise, sejam iniciadas para restaurar, ao menos parcialmente, o equilíbrio corporal de líquidos e eletrólitos.
Papel da gliconeogênese renal na homeostase da glicose
Tanto rim quanto fígado expressam as enzimas necessárias para aumentar o pool de glicose por gliconeogênese e a secreção de glicose armazenada como glicogênio. Enquanto o rim contribui pouco para o estoque de glicose durante um jejum noturno, ele contribui com aproximadamente 50% da produção endógena de glicose durante um jejum prolongado (> 40 horas). Uma vez que seus estoques de glicogênio são mínimos, nos rins predomina a gliconeogênese, processo estimulado pela adrenalina, não afetado pelo glucagon e inibido pela insulina.
Gliconeogênese hepática
A gliconeogênese hepática é igualmente importante na manutenção da concentração normal da glicose sanguínea, porque a gliconeogênese só ocorre de modo considerável quando a concentração de glicose cai abaixo da normal. Nesse caso, grande quantidade de aminoácidos e de glicerol dos triglicerídeos é convertida em glicose, auxiliando, desse modo, a manter a concentração glicêmica relativamente normal.
Metabolismo de Gorduras
Embora a maioria das células corporais metabolize gordura, certos aspectos do metabolismo lipídico ocorrem, em sua maior parte, no fígado. No metabolismo lipídico, o fígado realiza as seguintes funções específicas:
1. Oxidação dos ácidos graxos para suprir energia para outras funções corporais.
2. Síntese de grandes quantidades de colesterol, fosfolipídios e da maior parte das lipoproteínas.
3. Síntese de gordura, a partir das proteínas e carboidratos.
Para obter energia dos lipídios neutros, a gordura é primeiramente dividida em glicerol e ácidos graxos; então os ácidos graxos são divididos por b-oxidação, em radicais acetil de dois carbonos que formam a acetilcoenzima A (acetil-CoA). Esta pode entrar no ciclo do ácido cítrico e ser oxidada para liberar tremendas quantidades de energia. A b-oxidação pode ocorrer em todas as células do corpo, mas acontece com rapidez especial nas células hepáticas. O próprio fígado não pode utilizar toda a acetil-CoA que é formada; em vez disso, ela é convertida pela condensação de duas moléculas de acetil-CoA, em ácido acetoacético, ácido muito solúvel que passa das células hepáticas para o líquido extracelular, sendo então transportado para o corpo para ser absorvido por outros tecidos. Esses tecidos reconvertem o ácido acetoacético a acetil-CoA e, então, oxidam-na do modo usual. Desse modo, o fígado é responsável pela maior parte do metabolismo lipídico.
Cerca de 80% do colesterol sintetizado no fígado é convertido em sais biliares, que são secretados na bile; o restante é transportado nas lipoproteínas e carreado pelo sangue para as células dos tecidos por todo o corpo. Os fosfolipídios também são sintetizados no fígado e transportados, na maior parte, nas lipoproteínas. Tanto o colesterol quanto os fosfolipídios são utilizados pelas células para formar membranas, estruturas intracelulares e múltiplas substâncias químicas, importantes para a função celular.
Quase toda a síntese corporal de lipídios dos carboidratos e das proteínas também ocorre no fígado. Depois que a gordura é sintetizada no fígado, ela é transportada nas lipoproteínas para o tecido adiposo de modo a ser armazenada.
Metabolismo de Proteínas
O corpo não pode dispensar a contribuição hepática ao metabolismo proteico, por mais do que uns poucos dias, sem que lhe sobrevenha a morte. As funções hepáticas mais importantes, no metabolismo proteico são as seguintes:
1. Desaminação dos aminoácidos.
2. Formação de ureia para remoção da amônia dos líquidos corporais.
3. Formação das proteínas plasmáticas.
4. Interconversões entre os diversos aminoácidos e síntese de outros compostos a partir deles.
A desaminação dos aminoácidos é necessária antes que possam ser usados como energia ou convertidos em carboidratos ou lipídios. Pequena parcela da desaminação pode ocorrer em outros tecidos corporais, especialmente nos rins, mas essa é muito
menos importante do que a desaminação dos aminoácidos pelo fígado.
A formação hepática de ureia remove a amônia dos líquidos corporais. Grande quantidade de amônia é formada pelo processo de desaminação e quantidades adicionais são continuamente formadas nos intestinos por bactérias, sendo então absorvidas para o sangue. Por conseguinte, se o fígado não formar a ureia, a concentração plasmática da amônia se elevará rapidamente, resultando em coma hepático e morte. De fato, mesmo grande diminuição do fluxo sanguíneo pelo fígado — como ocorre ocasionalmente, quando uma derivação (shunt) se desenvolve entre as veias porta e cava — pode provocar excesso de amônia no sangue, condição extremamente tóxica.
Essencialmente, todas as proteínas plasmáticas, com exceção de parte das gamaglobulinas, são formadas pelas células hepáticas, o que representa cerca de 90% de todas as proteínas plasmáticas. As gamaglobulinas restantes são anticorpos formados principalmente pelos plasmócitos no tecido linfático do corpo. O fígado pode formar proteínas plasmáticas na intensidade máxima de 15 a 50 g/dia. Portanto, mesmo que cerca da metade das proteínas plasmáticas seja perdida pelo organismo, elas podem ser repostas em 1 ou 2 semanas.
A depleção das proteínas do plasma provoca rápida mitose dos hepatócitos e crescimento do fígado para maior tamanho; esses efeitos estão associados à rápida produção de proteínas plasmáticas, até que sua concentração no plasma retorne ao normal. Na doença hepática crônica (p. ex., cirrose), as proteínas do plasma, tais como a albumina, podem cair a níveis muito baixos, produzindo edema generalizado e ascite, conforme explicado no Capítulo 30.
Dentre as funções mais importantes do fígado, encontra-se a capacidade de sintetizar certos aminoácidos, assim como outros compostos químicos importantes a partir dos aminoácidos. Por exemplo, os denominados aminoácidos não essenciais podem ser sintetizados pelo fígado. Para realizar esta função, primeiro um cetoácido com a mesma composição química (exceto pelo oxigênio ceto) do aminoácido a ser formado é sintetizado. Então, o radical amina é transferido por meio de diversos estágios de transaminação, de aminoácido disponível ao cetoácido, para tomar o lugar do oxigênio ceto.
Efeito da Corticotropina e dos Glicocorticoides sobre a Gliconeogênese.
Quando quantidades normais de carboidratos não estão disponíveis para as células, a adeno-hipófise, por motivos que ainda não foram completamente esclarecidos, começa a secretar quantidades aumentadas do hormônio corticotropina. Essa secreção leva o córtex adrenal a produzir grandes quantidades de hormônios glicocorticoides, em especial o cortisol. Por sua vez, o cortisol mobiliza proteínas essencialmente de todas as células do organismo, disponibilizando-as sob a forma de aminoácidos nos líquidos corporais. Elevada proporção desses aminoácidos é de imediato desaminada no fígado e fornece substratos ideais para a conversão em glicose. Assim, um dos métodos mais importantes para promoção da gliconeogênese é a liberação de glicocorticoides do córtex adrenal.
12 - Proteólise muscular com o ciclo alanina glicose (gliconeogênese)?
Proteólise e ciclo da alanina glicose (gliconeogênese)
O músculo quando está em atividade utiliza-se da glicose para gerar energia, tendo como produto da via glicolítica a forma Piruvato. No musculo, haverá piruvato e glutamato, sendo que ambos serão substratos para a enzima ALT (alanina amino transferase), que vai passar o grupamento amina do glutamato para o piruvato, convertendo-o no aminoácido Alanina. A cadeia remanescente do glutamato é a alfa ceto-glutarato. Já a alanina por sua vez, agora consegue entrar/cair na corrente sanguínea e chegar no fígado. No fígado haverá ALT e alfa-ceto-glutarato, sendo assim, a alanina realizará o caminho inverso, devolvendo esse grupamento amino para o alfa-ceto-glutarato através da enzima ALT novamente. Devolvendo esse grupamento amino ao glutamato, a alanina se converterá em piruvato e através da gliconeogênese formando glicose. Essa glicose será direcionada para a corrente sanguínea onde será direcionada para o músculo para ser novamente oxidada e assim ser utilizada na formação de ATP. Já o glutamato formado através da reação, vai liberar seu grupamento amino que vai cair no ciclo da ureia que será excretada pela urina.

O Diabetes Causa Depleção das Proteínas do Organismo. A incapacidade de utilização da glicose como fonte de energia leva ao aumento da utilização e à diminuição do armazenamento das proteínas, assim como dos lipídios. Por conseguinte, a pessoa portadora de diabetes melito grave não tratado apresenta
perda de peso rápida e astenia (ausência de energia), apesar de ingerir grande quantidade de alimentos (polifagia). Sem tratamento, essas anormalidades metabólicas podem provocar severo consumo dos tecidos corporais e óbito, em poucas semanas.
Depleção dos Depósitos Alimentares dos Tecidos Corporais durante Jejum prolongado
Embora os tecidos usem, preferencialmente, os carboidratos em vez das gorduras e proteínas como fonte de energia, a quantidade de carboidratos armazenada nas condições normais em todo o corpo é apenas de poucas centenas de gramas (principalmente glicogênio no fígado e nos músculos), podendo suprir a energia requerida pelas funções corporais por talvez meio dia. Portanto, exceto pelas primeiras horas iniciais da inanição, os efeitos principais são a progressiva depleção da proteína e da gordura teciduais. Uma vez que a gordura é a fonte principal de energia (na pessoa normal, algo em torno de 100 vezes a energia dos carboidratos está armazenada sob a forma de energia das gorduras), a intensidade de depleção adiposa continua constante, até que a maior parte dos depósitos gordurosos corporais tenha se esgotado.
A proteína passa por três fases de depleção: a princípio, depleção rápida, seguida por perda com velocidade muito diminuída e, por fim, nova depleção rápida, logo antes da morte. A depleção rápida inicial é provocada pelo uso da proteína facilmente mobilizável para metabolização direta ou para conversão à glicose e, então, para o metabolismo glicídico, principalmente pelo cérebro. Depois que os depósitos proteicos prontamente mobilizáveis tiverem sido depletados durante a fase inicial da privação, a proteína restante não é tão facilmente removida. Nesse momento, a gliconeogênese diminui de um terço a um quinto de seu nível anterior, e a depleção proteica fica extremamente diminuída. A disponibilidade reduzida de glicose precipita, então, uma série de eventos que levam à excessiva utilização de gordura e à conversão de alguns dos produtos da degradação lipídica a corpos cetônicos, produzindo o estado de cetose. Os corpos cetônicos, como a glicose, podem cruzar a barreira hematoencefálica e ser utilizados pelas células neurais, como fonte de energia. Portanto, cerca de dois terços da energia do cérebro são agora derivados desses corpos cetônicos, principalmente, b- hidroxibutirato. Essa sequência de eventos leva, pelo menos, à preservação parcial dos depósitos proteicos do corpo.
Finalmente, chega o momento em que os depósitos gordurosos estão quase completamente depletados e em que a única fonte remanescente de energia é a proteína. Nesse momento, os depósitos proteicos, uma vez mais, entram em estágio de depleção rápida. Como as proteínas são igualmente essenciais para a manutenção das funções celulares, a morte de forma comum sobrevém quando as proteínas corporais estão depletadas acerca da metade de seu nível normal.
13 - Qual é a relação entre a lipólise e a cetoacidose diabética?
A deficiência severa de insulina determina o aumento da lipólise (por falta da ação inibitória da insulina sobre a atividade da lipase hormônio-sensível, no tecido adiposo), aumento da oferta de ácidos graxos livres no fígado e consequentemente aumento da cetogênese hepática (maior beta-oxidação lipídica nas mitocôndrias, por diminuição da malonil-coenzima A e por aumento da atividade da carnitina-palmitoiltransferase -CPTF). Como os corpos cetônicos são ácidos orgânicos, seu acúmulo determinará acidose metabólica com aumento do ânion-gap. A cetogênese é bloqueada pela ação da insulina, mesmo quando em concentrações muito baixas, por isso a cetoacidose só acontecerá quando a deficiência da insulina for absoluta (como em DM1) ou quando os níveis de hormônios contrarreguladores insulínicos (cortisol, GH e glucagon) forem extremamente elevados na presença de uma deficiência relativa de insulina (DM2, na vigência de intercorrências médicas graves – infarto, sepse hiperflicemia, depleção de volume, distúrbios hidroeletrolíticos)
Falta de inibição da insulina sobre a lipase hormônio-sensível lipólise aumentada aumento dos ácidos graxos circulantes transportados para o fígado aumento da atividade da CPTF pelo estímulo do glucagon beta-oxidação dos ácidos graxos e síntese de corpos cetônicos (acetona, ácido aceto-acético, beta-hidroxibutírico)
14 - Qual é o tratamento para a diabetes tipo 1 e 2, medicamentoso e não medicamentoso?
DM tipo 1
É feita apenas com as medidas de mudanças de hábitos junto a aplicação de insulina, sendo ela de ação prolongada ou associações de insulina.
Sugestão da SBD quanto à evolução terapêutica do DM1, na presença de hipoglicemias frequentes, hipoglicemia grave e hipoglicemias noturnas em frequências elevadas:
Insulina humana NPH + análogo de insulina de ação rápida
Análogos de insulina de ação prolongada + de ação rápida
Análogos de insulina de ação ultraprolongada5 + de ação rápida
Outras tecnologias: monitorização contínua da glicose, aplicativos, SICI, SICI closed-loop híbrido.
DM tipo 2
Para adequado controle, prevenção e retardo do aparecimento de complicações relacionadas à doença, é indispensável, além do controle glicêmico adequado, o controle dos níveis pressóricos e lipídicos. São indicadas também a educação alimentar, a prática de atividades físicas e a perda de peso em caso de sobrepeso ou obesidade.
Além das alterações em estilo de vida, o uso de drogas antidiabéticas é imprescindível para melhor manejo clínico, são elas:
· Secretagogos de insulina -> Sulfonilureias, Glinidas
· Metformina
· Triazolidinedionas
· Inibidores da alfaglicosidade (acarbose)
· Inibidores da dipeptidil peptidase IV (gliptinas)
· Agonistas (análogos) da GLP-1
· Inibidores da SGLT2
· Associações -> ex: sulfonilureia + metformina + glitazona ou metformina + sulfonilureia + inibidor de DPP-IV ou Glicazida + Metformina)
· Insulina -> Insulina humana, animal ou análogos
Cirurgia bariátrica em obesos mórbidos com foco na normalização da glicemia (mostra-se efetiva em 70% a 80% dos pacientes com DM2). Também é possível a abordagem por “Bypass intestinal”, excluindo o duodeno e jejuno proximal ou a “interposição ileal”, onde o íleo é interposto entre o duodeno e jejuno. Ambas as técnicas focam na passagem do bolo alimentar mais rapidamente ao íleo, o que parece potencializar a secreção de GLP-1 pelas células L, presentes nessa região.
O acompanhamento do paciente, tal como o controle das comorbidades são importantes para uma evolução satisfatória e controlada da doença.

15 - O que é síndrome metabólica (de acordo com a OMS e Associação Brasileira de Endocrinologia) e quais suas consequências?
Sindrome Metabólica segundo a SBEM
O termo Síndrome Metabólica descreve um conjunto de fatores de risco metabólico que se manifestam num indivíduo e aumentam as chances de desenvolver doenças cardíacas, derrames e diabetes. A Síndrome Metabólica tem como base à resistência à ação da insulina, daí também ser conhecida como síndrome de resistência à insulina. Isto é: a insulina age menos nos tecidos, obrigando o pâncreas a produzir mais insulina e elevando o seu nível no sangue. Alguns fatores contribuem para o aparecimento: os genéticos, excesso de peso (principalmente na região abdominal) e a ausência de atividade física.
O diagnóstico é dado quando três ou mais fatores de risco estiverem presentes numa mesma pessoa.
Veja, a seguir, quais são eles:
Fatores de Risco
Grande quantidade de gordura abdominal – Em homens cintura com mais de 102cm e nas mulheres maior que 88cm.
Baixo HDL ("bom colesterol") – Em homens menos que 40mg/dl e nas mulheres menos do que 50mg/dl.
Triglicerídeos elevado (nível de gordura no sangue) – 150mg/dl ou superior
Pressão sanguínea alta – 135/85 mmHg ou superior ou se está utilizando algum medicamento para reduzir a pressão
Glicose elevada – 110mg/dl ou superior.
Ter três ou mais dos fatores acima é um sinal da presença da resistência insulínica, que é um hormônio produzido pelo pâncreas. Esta resistência significa que mais insulina do que a quantidade normal está sendo necessária para manter o organismo funcionando e a glicose em níveis normais.
Quem Tem Risco de Desenvolver a Síndrome?
Segundo as pesquisas uma em cada cinco adultos nos Estados Unidos tem a Síndrome Metabólica. A Síndrome ocorre com mais frequência entre os africanos, hispânicos, asiáticos e americanos nativos.
Para a maioria das pessoas o desenvolvimento da síndrome aumenta com o envelhecimento. O risco aumenta se a pessoa tem uma vida sedentária, sem atividade física e se tem:
aumento do peso, principalmente na região abdominal (circunferência da cintura);
histórico de diabetes na família;
níveis elevados de gordura no sangue;
pressão alta.
A maioria das pessoas que tem a Síndrome Metabólica sente-se bem e não tem sintomas. Entretanto, elas estão na faixa de risco para o desenvolvimento de doenças graves, como as cardiovasculares e o diabetes.
Qual o Tratamento?
O aumento da atividade física e a perda de peso são as melhores formas de tratamento, mas pode ser necessário o uso de medicamentos para tratar os fatores de risco. Entre eles estão os chamados "sensibilizadores da insulina", que ajudam a baixar a açúcar no sangue, os medicamentos para pressão alta e os para baixar a gordura no sangue.
Se você identificou em seu organismo alguns dos fatores, descritos acima, procure um profissional. O endocrinologista é o especialista em hormônios e metabolismo, que pode fazer o diagnóstico, tratamento e acompanhamento mais adequado se você tiver a síndrome.
ATP III
Pelo menos três dos seguintes critérios:
1 Circunferência da cintura > 102 cm em homens ou 88 cm em mulheres
2 Triglicérides séricos ≥ 150 mg/dL
3 Pressão arterial ≥ 130×85 mmHg
4 Colesterol HDL-C < 40 mg/dL em homem ou < 50 em mulheres
5 Glicose sérica > 100mg/dL (inclui diabetes)
Esses achados são característicos da dislipidemia aterogênica, alteração das gorduras sanguíneas envolvidas nas obstruções das artérias.
OMS (Organização Mundial da Saúde)
Diabetes, glicemia de jejum alterada, intolerância à glicose ou resistência à insulina (por estudos de clamp) e pelo menos dois fatores dos seguintes:
1 Relação cintura/quadril > 0,90 em homens ou > 0,85 em mulheres ou obesidade IMC
> 30 kg/m2 Triglicérides séricos ≥ 150 mg/dL
2 Colesterol HDL < 35 mg/dL em homens ou < 39 mg/dL em mulheres
3 Pressão arterial ≥ 140/90 mmHg
4 Microalbuminúria positiva
IDF (International Diabetes Federation)
O critério da International Diabetes Federation (IDF) foi publicado em 2005 e contempla diferenças nos valores de circunferência de cintura conforme grupo étnico. A obesidade abdominal é necessária para o diagnóstico. Esse critério ainda contempla outros fatores de risco.
Aumento de circunferência de cintura (conforme população) mais 2 dos seguintes critérios:
1 TG 150 mg/dL (ou em tratamento para dislipidemia)
2 Colesterol HDL < 40 mg/dL em homem ou <50 mg/dL em mulher (ou em tratamento para dislipidemia)
3 Pressão arterial sistólica ≥130 mmHg ou pressão arterial sistólica ≥ 85 mm Hg ou em tratamento para hipertensão arterial
4 Glicemia de jejum > 100mg/dL (pré-diabetes e diabetes)
Critério harmonizado para Síndrome Metabólica
Em 2009, várias sociedades médicas (National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; e International Association for the Study of Obesity) publicaram um critério harmonizado para síndrome metabólica (3):
1 Aumento da circunferência de cintura conforme etnia
2 Aumento dos triglicérides* ≥ 150mg/dL
3 Redução do HDL-colesterol* <40 mg/dL em homens / <50 mg/dL em mulheres
4 Aumento da pressão arterial – pressão sistólica ≥130 e/ou diastólica ≥85 mmHg
5 Aumento da glicemia de jejum ≥100 mg/dL
*Tratamento medicamentoso pode ser usado como um indicador alternativo
As medicações mais utilizadas para combater os triglicérides aumentados e HDL reduzidos são fibratos e ácido nicotínico;
A maioria dos pacientes com diabetes tipo 2 terão também síndrome metabólica segundo esses critérios.

Como saber se a circunferência abdominal está aumentada?
A obesidade abdominal é avaliada com a fita métrica. A circunferência da cintura é aferida na região mais estreita do abdômen ou no ponto médio entre a última costela e a crista ilíaca e muitas vezes usada como sinônimo de circunferência abdominal. Na impossibilidade de determinar a região mais estreita, pode-se aferir com a fita métrica passando sobre a cicatriz umbilical.
De acordo com a etnia e sociedade médica, são considerados diferentes valores de normalidade para definir a obesidade abdominal, conforme quadro abaixo.
Bibliografia:
-GUYTON, A.C. e HALL, J.E. - Tratado de Fisiologia Médica. Editora Elsevier. 13a ed., 2017
-SILVERTHORN, D. - Fisiologia Humana: Uma Abordagem Integrada, 7a Edição, Artmed, 2017.
-DIEHL, A. e BRANDÃO NETO, R.A – Principais temas em Endocrinologia para residência médica. V.2. São Paulo: Medcel, 2016
-HAMMER, G. D. - Fisiopatologia da doença: uma introdução à medicina 7. ed. - Porto Alegre: AMGH, 2016.
SANTOS, Carlos Eduardo; SCHRANK, Yolanda; KUPFER, Rosane. Análise crítica dos critérios da OMS, IDF e NCEP para síndrome metabólica em pacientes portadores de diabetes melito tipo 1. Arq Bras Endocrinol Metab. 2009;53(9):1096-102. Disponível em:
<https://www.scielo.br/j/abem/a/DYBJhcJCqwP4R4g4wTTjVCc/?format=pdf&lang=pt>
<https://drasuzanavieira.med.br/2012/05/22/sindrome-metabolica/#:~:text=OMS%20(Organização%20Mundial%20da%20Saúde)&text=Relação%20cintura%2Fquadril%20%3E%200%2C,arterial%20≥%20140%2F90%20mmHg>
<https://diretriz.diabetes.org.br/tratamento-do-diabetes-mellitus-tipo-1-no-sus/>
<https://diabetesatlas.org/idfawp/resource-files/2022/12/IDF-T1D-Index-Report.pdf>
<https://www.gov.br/conitec/ptbr/midias/protocolos/20201113_pcdt_diabete_melito_tipo_2_29_10_2020_final.pdf>
<https://www.endocrino.org.br/a-sindrome-metabolica/>
<https://bvsms.saude.gov.br/sindrome-metabolica/>
-GUYTON, A.C. e Hall J.E.– Tratado de Fisiologia Médica. Editora Elsevier. 13a ed., 2017
-SILVERTHORN, D. Fisiologia Humana: Uma Abordagem Integrada, 7a Edição, Artmed, 2017.
MATERIAL EXTRA:







Comentários