NCS - TUTORIA - 03/04/23 - SP 2.3
- thikow

- 3 de abr. de 2023
- 21 min de leitura
Atualizado: 21 de mai. de 2023
SP 2.3 - Até que enfim!
PROBLEMAS
· Dificuldade de engravidar
· Oligospermia
HIPÓTESES
· Idade do casal teve influencia negativa na gravidez
· Oligospermia é a causa da dificuldade de engravidar
· Mulher tem dificuldade de manter um embrião em desenvolvimento
· A fertilização in vitro aumenta a chance de fecundação
· Fertilização in vitro não é tão eficaz
· Saúde mental da mulher pode interferir na capacidade de engravidar
PERGUNTAS
1- Como é a fertilização natural? (Etapas)
2- Quais são os métodos de fertilização in vitro?
3- Como é o desenvolvimento embrionário até a terceira semana?
4- O que é oligospermia
5- Quais fatores influenciam a fertilidade masculina e feminina?
6- A saúde mental interfere na capacidade de engravidar?
7- Quais são os principais métodos diagnósticos para infertilidade?
8- O que é o planejamento familiar pelo SUS?
9- Como acontece a determinação do sexo biológico? Fale sobre o gene SRY.
10- O que são células tronco embrionárias?
Respostas:
1- Como é a fertilização natural? (Etapas)
FERTILIZAÇÃO
A fertilização, processo pelo qual os gametas masculino e feminino se fundem, ocorre na região ampular da tuba uterina – porção mais larga da tuba e próxima ao ovário (ver Figura 3.4). Os espermatozoides podem permanecer viáveis no sistema genital feminino por vários dias.
Apenas 1% do esperma depositado na vagina penetra o colo do útero, onde os espermatozoides podem sobreviver por muitas horas. O movimento deles do colo do útero para a tuba uterina ocorre pelas contrações musculares do útero e da tuba uterina, e muito pouco por sua própria propulsão. A viagem desde o colo do útero até o oviduto pode ocorrer rapidamente, em 30 min ou até 6 dias. Após alcançarem o istmo, os espermatozoides se tornam menos móveis e param sua migração. Na oocitação, eles se tornam móveis novamente, talvez por causa das substâncias quimiotáticas produzidas pelas células do cúmulo que cercam o oócito e nadam pela ampola, onde a fertilização normalmente ocorre. Os espermatozoides não são capazes de fertilizar o oócito imediatamente após a chegada ao sistema genital feminino; em vez disso, eles devem sofrer capacitação e reação acrossômica para adquirirem essa capacidade.
A capacitação é um período de condicionamento no sistema genital feminino que, nos seres humanos, dura aproximadamente 7 horas. Assim, chegar logo à ampola não é uma vantagem, uma vez que a capacitação ainda não ocorreu e esses espermatozoides não conseguem fertilizar o oócito. A maior parte desse condicionamento durante a capacitação acontece na tuba uterina e envolve as interações epiteliais entre os espermatozoides e a superfície mucosa da tuba. Durante esse período, uma camada de glicoproteínas e proteínas plasmáticas seminais é removida da membrana plasmática que recobre a região acrossômica do espermatozoide. Apenas os espermatozoides capacitados podem passar pelas células da coroa radiada e sofrer a reação acrossômica.
A reação acrossômica, que ocorre após a ligação à zona pelúcida, é induzida por proteínas da mesma. Essa reação culmina na liberação das enzimas necessárias para a penetração da zona pelúcida, incluindo substâncias semelhantes à acrosina e à tripsina (ver Figura 3.5).
As fases da fertilização incluem:
■Fase 1: penetração da coroa radiada
■Fase 2: penetração da zona pelúcida
■Fase 3: fusão entre as membranas do oócito e do espermatozoide.
Fase 1 | Penetração da coroa radiada
Dos 200 a 300 milhões de espermatozoides normalmente depositados no sistema genital feminino, apenas 300 a 500 alcançam o local de fertilização. Somente um deles fertiliza o oócito. Acredita-se que os outros espermatozoides ajudem o fertilizador a penetrar as barreiras que protegem o gameta feminino. Os espermatozoides capacitados atravessam livremente as células da coroa (ver Figura 3.5).
Fase 2 | Penetração da zona pelúcida
A zona pelúcida é uma camada de glicoproteínas que cerca o oócito, facilita e mantém a ligação do espermatozoide e induz a reação acrossômica. Tanto a ligação quanto a reação acrossômica são mediadas pelo ligante ZP3, uma proteína da zona. A liberação das enzimas acrossômicas (acrosina) possibilita que os espermatozoides penetrem a zona, entrando em contato com a membrana plasmática do oócito (ver Figura 3.5). A permeabilidade da zona pelúcida se altera quando a cabeça do espermatozoide contata a superfície do oócito. Esse contato resulta na liberação das enzimas lisossomais dos grânulos corticais que estão alinhados na membrana plasmática do oócito. Por sua vez, essas enzimas alteram as propriedades da zona pelúcida (reação da zona), para evitar a penetração do espermatozoide e inativar os locais de receptores específicos de espécies para o espermatozoide na superfície da zona. Outros espermatozoides são encontrados imersos na zona pelúcida, mas parece que apenas um é capaz de penetrar o oócito (ver Figura 3.6).
Fase 3 | Fusão entre as membranas do oócito e do espermatozoide
A adesão inicial do espermatozoide ao oócito é mediada parcialmente pela interação de integrinas do oócito com seus ligantes, desintegrinas, no espermatozoide. Após a adesão, as membranas plasmáticas do espermatozoide e do oócito se fundem (ver Figura 3.5). Como a membrana plasmática que cobre a cabeça acrossômica desaparece durante a reação acrossômica, a fusão de fato é alcançada entre a membrana do oócito e a membrana que recobre a região posterior da cabeça do espermatozoide (ver Figura 3.5). Nos seres humanos, tanto a cabeça quanto a cauda do espermatozoide entram no citoplasma do oócito, mas a membrana plasmática é deixada para trás, na superfície do oócito. Tão logo o espermatozoide entre no oócito, este responde de três maneiras:
1.Reações cortical e de zona. Como resultado da liberação dos grânulos corticais dos oócitos, que contêm enzimas lisossomais, a membrana do oócito se torna impenetrável a outros espermatozoides, e a zona pelúcida altera sua estrutura e sua composição para evitar a ligação e a penetração do espermatozoide. Essas reações evitam a poliespermia (penetração de um ou mais espermatozoides no oócito)
2.Continuação da segunda divisão meiótica. O oócito termina sua segunda divisão meiótica imediatamente após a entrada do espermatozoide. Uma das células-filhas, que recebe pouco ou nenhum citoplasma, é conhecida como segundo corpúsculo polar; a outra é o oócito definitivo ou óvulo. Seus cromossomos (22 mais X) se dispõem em um núcleo vesicular conhecido como pró-núcleo feminino
3.Ativação metabólica do óvulo. O fator de ativação provavelmente é carregado pelo espermatozoide. A ativação inclui eventos moleculares e celulares associados ao início da embriogênese.
Enquanto isso, o espermatozoide se move para frente até que fique próximo do pró-núcleo feminino. Seu núcleo se torna aumentado e forma o pró-núcleo masculino (ver Figura 3.6); a cauda se desprende e degenera. Morfologicamente, os pró-núcleos masculino e feminino não são distinguíveis e, por fim, ficam em contato íntimo e perdem seus envelopes nucleares (ver Figura 3.7A). Durante o crescimento dos pró-núcleos masculino e feminino (ambos haploides), cada pró-núcleo deve replicar seu DNA. Se isso não ocorrer, cada célula do zigoto no estágio de duas células terá apenas metade da quantidade normal de DNA. Imediatamente após a síntese de DNA, os cromossomos se organizam no fuso em preparo para a divisão mitótica normal. Os 23 cromossomos maternos e os 23 paternos (duplicados) separam-se longitudinalmente no centrômero, e as cromátides-irmãs se movem para polos opostos, fornecendo às duas primeiras células do zigoto a quantidade diploide de cromossomos e de DNA (ver Figura 3.6D e E). Conforme as cromátides-irmãs se movem para polos opostos, aparece um sulco profundo na superfície da célula, dividindo o citoplasma gradualmente em duas partes (ver Figuras 3.6F e 3.7B).
Os principais resultados da fertilização são:
1. ■Restauração da quantidade diploide de cromossomos, metade do pai e metade da mãe. Assim, o zigoto contém uma nova combinação cromossômica diferente da mãe e do pai
2. ■Determinação do sexo do novo indivíduo. Um espermatozoide carregando um X produz um embrião feminino (XX), e um espermatozoide carregando um Y produz um embrião masculino (XY). Assim, o sexo cromossômico do embrião é determinado na fertilização
3. ■Início da clivagem. Sem a fertilização, geralmente o oócito degenera 24 h após a oocitação.
2- Quais são os métodos de fertilização in vitro?
Há 2 variantes dada pela fertilização clássica e a ICSI. Na fertilização clássica deixamos os espermatozoides entrarem espontaneamente no interior do óvulo, já a técnica de ICSI (injeção intracitoplasmática de espermatozoides) é um processo mais sofisticado, que inicia com a mulher usando medicamentos que amplificam a ovulação.
Após esse início, há o desenvolvimento dos embriões, que serão acompanhados e selecionado(s) para ser(em) transferido(s) ao útero.
Com a seleção de espermatozoides usando microscópio (capacitação espermática) é possível separar aqueles que movimentam e tem um formato adequado para o bom desenvolvimento dos embriões.
Essa técnica permite uma tentativa com casos de muito poucos óvulos e/ou espermatozoides.
Além dos tratamentos citados, ainda é possível tratar homens que não tem espermatozoides na ejaculação e utilizar técnicas com microscopia, para que sejam encontradas pequenas amostras, e assim, realizar a fertilização.
Para quem é indicado?
A FIV – ICSI é Indicada para alterações mais graves. As principais indicações incluem:
-abortamentos de repetição;
-alta taxa de fragmentação de DNA do espermatozoide;
-casais com histórico de doença genética familiar, como fibrose cística e distrofia muscular;
-casais com ISCA (infertilidade sem causa aparente);
-falhas de outros tratamentos como inseminação intra-uterina e coito programado;
-homens azoospérmicos;
-homens com alterações seminais, como baixa concentração de espermatozoides, redução da -motilidade e morfologia inadequada;
-homens vasectomizados ou com obstrução da saída dos espermatozoides por outras causas -como ausência congênita dos ductos deferentes (CBAVD – congenital bilateral absence of vas deferens) ou infecções;
-mulheres com tubas uterinas danificadas ou obstruídas;
-mulheres laqueadas;
-mulheres que sofrem de endometriose;
-mulheres com baixa reserva ovariana;
-pacientes com alterações de cariótipo, incluindo mosaicismos.
Taxa de sucesso da FIV fica entre 30 a 40%
3- Como é o desenvolvimento embrionário até a terceira semana?
As células germinativas primordiais (CGPs) são derivadas do epiblasto durante a gastrulação e migram para a parede da vesícula vitelínica na quarta semana e, a seguir, para a gônada indiferenciada (Figura 2.1), aonde elas chegam ao fim da quinta semana. Na preparação para a fertilização, as células germinativas masculina e feminina sofrem gametogênese, que inclui meiose e citodiferenciação. Durante a meiose I, os cromossomos homólogos se pareiam e trocam material genético; na meiose II, as células não conseguem replicar o DNA, e cada célula acaba com um número haploide de cromossomos e metade da quantidade de DNA de uma célula somática normal (ver Figura 2.4). Assim, os gametas femininos e masculinos maduros têm 22 cromossomos mais um X ou 22 mais Y, respectivamente.
Os defeitos congênitos se originam de anomalias no número ou na estrutura dos cromossomos e de mutações em genes únicos. Aproximadamente 10% dos principais defeitos ao nascimento resultam de anomalias cromossômicas, e 8%, de mutações gênicas. As trissomias (um cromossomo extra) e as monossomias (perda de um cromossomo) surgem durante a mitose ou a meiose. Durante a meiose, os cromossomos homólogos normalmente se pareiam e, em seguida, separam-se. Entretanto, se não ocorrer separação (não disjunção), uma célula recebe muitos cromossomos e outra recebe poucos (ver Figura 2.6). A incidência das anomalias numéricas cromossômica aumenta com a idade da mãe, particularmente em mulheres acima de 35 anos de idade. As anomalias estruturais dos cromossomos incluem grandes deleções (síndrome do miado do gato) e microdeleções. Estas envolvem genes contíguos e podem resultar em defeitos como a síndrome de Angelman (deleção materna, cromossomo 15q11-15q13) ou a síndrome de Prader-Willi (deleção paterna, cromossomo 15q11-15q13). Como essas síndromes dependem de o material genético afetado ter sido herdado da mãe ou do pai, também são um exemplo de impressão (imprinting) genômica. As mutações gênicas podem ser dominantes (apenas um gene do par alélico tem de ser afetado para produzir uma alteração) ou recessivas (ambos os pares alélicos gênicos devem sofrer mutação). As mutações responsáveis por muitos defeitos congênitos afetam os genes envolvidos com o desenvolvimento embriológico normal.
Entre as técnicas de diagnóstico para identificar anormalidades genéticas, estão a citogenética para pôr à prova os números de cromossomo (ploidia) e técnicas de bandeamento de metáfase de alta resolução para pôr à prova pequenas deleções. A hibridização in situ por fluorescência (FISH, do inglês fluorescence in situ hibridization) usa as sondas fluorescentes de DNA para identificar cromossomos ou regiões de cromossomos específicos, a fim de determinar deleções, translocações e ploidia. Os microarranjos utilizam sequências pequenas de DNA em chips como sondas para detectar mutações e alterações em níveis de expressão de genes específicos. O sequenciamento de exomas sequencia a região de codificação da proteína de DNA (1% do DNA total; o exoma) para identificar mutações e polimorfismos responsáveis por defeitos e doenças congênitas. A técnica é precisa, oportuna e econômica em comparação com o sequenciamento de todo o gene.
Na mulher, a maturação a partir de uma célula germinativa primitiva até o gameta maduro, chamada de oogênese, começa antes do nascimento; no homem, chama-se espermatogênese e começa na puberdade. Nas mulheres, as CGPs formam oogônias. Após repetidas divisões mitóticas, algumas delas entram em meiose e param na prófase da meiose I para formar os oócitos primários. Por volta do sétimo mês, muitas oogônias remanescentes sofrem atresia, e apenas os oócitos primários permanecem cercados por uma camada de células foliculares derivadas do epitélio superficial do ovário (ver Figura 2.17). Juntos, formam o folículo primordial. Na puberdade, um conjunto de folículos em crescimento é recrutado e mantido a partir de uma reserva finita de folículos primordiais. Assim, a cada mês, de 15 a 20 folículos começam a crescer e, conforme amadurecem, passam por três estágios: (1) primário ou pré-antral; (2) vesicular ou antral; e (3) folículo vesicular maduro ou folículo de De Graaf. O oócito primário permanece na prófase da primeira divisão meiótica até que o folículo secundário esteja maduro. Nesse estágio, um pulso do hormônio luteinizante (LH) estimula o crescimento pré-ovulatório: a meiose I se completa, e um oócito secundário e um corpo polar são formados. O oócito secundário para na metáfase da meiose II aproximadamente 3 horas antes da ovulação e não completa essa divisão celular até a fertilização.
No homem, as células primordiais permanecem dormentes até a puberdade e apenas então se diferenciam em espermatogônias. Essas células-tronco dão origem aos espermatócitos primários, que passam por duas divisões meióticas sucessivas para produzir quatro espermátides (ver Figura 2.5). As espermátides passam por uma série de mudanças (espermiogênese) (ver Figura 2.24), incluindo: (1) a formação do acrossomo; (2) a condensação do núcleo; (3) a formação do colo, da porção média e da cauda; e (4) a perda da maior parte do citoplasma. O tempo necessário para que uma espermatogônia se torne um espermatozoide maduro é de aproximadamente 74 dias.
PRIMEIRA SEMANA
A cada ciclo ovariano, alguns folículos primários começam a crescer, mas, em geral, somente um alcança a maturidade plena e apenas um oócito é liberado na oocitação. Na oocitação, o oócito está em metáfase na segunda divisão meiótica e está cercado pela zona pelúcida e por algumas células granulosas (ver Figura 3.4). O movimento das fímbrias tubais carrega o oócito para a tuba uterina.
Antes que os espermatozoides possam fertilizar o oócito, têm de passar por:
1.Capacitação, período no qual uma capa de glicoproteínas e de proteínas plasmáticas seminais é removida da cabeça do espermatozoide
2.Reação acromossômica, durante a qual são liberadas substâncias semelhantes à acrosina e à tripsina, para penetrar a zona pelúcida.
Durante a fertilização, o espermatozoide precisa penetrar na:
1.Coroa radiada
2.Zona pelúcida
3.Membrana celular do oócito (ver Figura 3.5).
Tão logo o espermatozoide penetre no oócito:
1. O oócito termina sua segunda divisão meiótica e forma o pró-núcleo feminino
2. A zona pelúcida se torna impenetrável a outros espermatozoides
3. A cabeça do espermatozoide se separa da cauda, incha e forma o pró-núcleo masculino (ver Figuras 3.6 e 3.7).
Após os pró-núcleos replicarem seus DNAs, os cromossomos paterno e materno se misturam, dividem-se longitudinalmente e passam por uma divisão mitótica, dando origem ao estágio de duas células. Os resultados da fertilização são:
1.Restauração do número diploide de cromossomos
2.Determinação do sexo cromossômico
3.Início da clivagem.
A infertilidade é um problema para 15 a 30% dos casais e pode ser superada usando a tecnologia de reprodução assistida (TRA). A fertilização in vitro (FIV) envolve fertilizar os óvulos em um meio de cultura e colocá-los no útero no estágio de oito células. Em alguns casos, os óvulos são fertilizados pela injeção intracitoplasmática dos espermatozoides (ICSI), por meio da qual um único espermatozoide é injetado em um citoplasma do óvulo. Essas técnicas in vitro estão associadas a maior risco de defeitos congênitos, nascimentos prematuros, baixo peso ao nascer e nascimento múltiplo. Aproximadamente 1 a 2% de todos os nascimentos nos EUA ocorrem por TRA.
A clivagem é uma série de divisões mitóticas que resultam no aumento da quantidade de células, os blastômeros, os quais se tornam menores a cada divisão. Após três divisões, eles sofrem compactação, para se tornarem uma bola celular altamente agrupada com camadas interna e externa. Os blastômeros compactados se dividem para formar uma mórula de 16 células. Conforme a mórula entra no útero no terceiro ou no quarto dia após a fertilização, começa a aparecer uma cavidade, e se forma o blastocisto. A massa celular interna, que se forma por volta do período da compactação e que se desenvolverá no embrião em si, aloja-se em um dos polos do blastocisto. A massa celular externa, que envolve as células internas e a cavidade blastocística, formará o trofoblasto.
O útero está na fase secretória no período da implantação, e o blastocisto se implanta no endométrio ao longo da parede anterior ou posterior. Se a fertilização não ocorrer, então começa a fase menstrual, e as camadas endometriais esponjosa e compacta são liberadas. A camada basal permanece para regenerar as outras durante o ciclo seguinte

SEGUNDA SEMANA
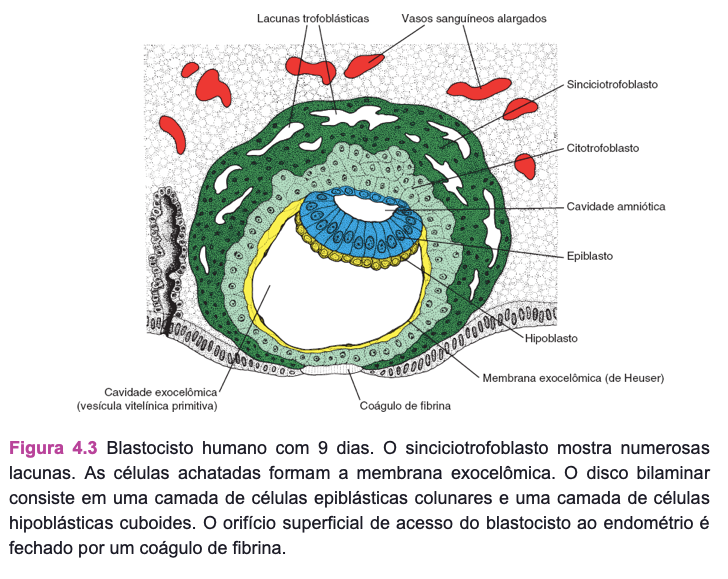
No início da segunda semana, o blastocisto está alojado parcialmente no estroma endometrial. O trofoblasto se diferencia em uma camada interna, que prolifera ativamente, o citotrofoblasto; e em uma camada externa, o sinciciotrofoblasto, que invade os tecidos maternos (ver Figura 4.1). No nono dia, desenvolvem-se lacunas no sinciciotrofoblasto. Subsequentemente, os sinusoides maternos são erodidos pelo sinciciotrofoblasto, o sangue materno entra na rede lacunar e, por volta da segunda semana, começa uma circulação uteroplacentária primitiva (ver Figura 4.6). Enquanto isso, o citotrofoblasto forma colunas celulares que penetram e são cercadas pelo sincício, as vilosidades primárias. No fim da segunda semana, o blastocisto está completamente alojado e seu orifício de entrada na mucosa está fechado (ver Figura 4.6).
Enquanto isso, a massa celular interna ou embrioblasto se diferencia em epiblasto e hipoblasto, formando, juntos, um disco bilaminar (ver Figura 4.6). As células epiblásticas originam os amnioblastos que recobrem a cavidade amniótica, superior à camada epiblástica. As células hipoblásticas são contínuas com a membrana exocelômica, e, juntas, elas recobrem a vesícula vitelínica primitiva (ver Figura 4.4). No fim da segunda semana, o mesoderma extraembrionário preenche internamente o espaço entre o trofoblasto e o âmnio, bem como a membrana exocelômica. Quando se desenvolvem vacúolos nesse tecido, forma-se o celoma extraembrionário ou cavidade coriônica (ver Figura 4.6). O mesoderma extraembrionário que recobre o citotrofoblasto e o âmnio é o mesoderma extraembrionário somático; a cobertura que cerca a vesícula vitelínica é o mesoderma extraembrionário esplâncnico (ver Figura 4.6).
A segunda semana do desenvolvimento é conhecida como a “semana do dois”:
1. O trofoblasto se diferencia em duas camadas: o citotrofoblasto e o sinciciotrofoblasto
2. O embrioblasto forma duas camadas: o epiblasto e o hipoblasto
3. O mesoderma extraembrionário se divide em duas camadas: as camadas somática e esplâncnica
4. Formam-se duas cavidades: a amniótica e a da vesícula vitelínica.
A implantação ocorre no fim da primeira semana. As células trofoblásticas invadem o epitélio e o estroma do epitélio subjacente com a ajuda de enzimas proteolíticas. A implantação também pode ocorrer fora do útero, como na cavidade retouterina, no mesentério, na tuba uterina ou no ovário (gravidez ectópica).



TERCEIRA SEMANA
O evento mais característico durante a terceira semana é a gastrulação. Ela começa com o surgimento da linha primitiva, que tem em sua parte cefálica o nó primitivo. Na região do nó e da linha, as células epiblásticas se movem para dentro (invaginam) para formar novas camadas, o endoderma e o mesoderma. As células que não migram através da linha primitiva, mas permanecem no epiblasto, formam o ectoderma. Assim, o epiblasto dá origem às três camadas germinativas, ectoderma, mesoderma e endoderma, e essas camadas formam todos os tecidos e órgãos (ver Figuras 5.2 e 5.3).
As células pré-notocordais que invaginam na região da fosseta primitiva se deslocam para a região cefálica até alcançarem a placa precordal. Elas se intercalam no endoderma como a placa notocordal (ver Figura 5.3). Com a continuação do desenvolvimento, a placa se desprende do endoderma e forma um tubo sólido, a notocorda. Essa estrutura determina um eixo na linha média, que funcionará como a base do esqueleto axial (ver Figura 5.3). As partes cefálica e caudal do embrião são estabelecidas antes que a linha primitiva tenha se formado. Assim, as células do hipoblasto (endoderma) na margem cefálica do disco formarão o EVA, que expressa genes de formação da cabeça, incluindo OTX2, LIM1 e HESX1, bem como o fator solúvel cerberus. NODAL, um membro da família de genes TGF-β é, então, ativado e inicia e mantém a integridade do nó e da linha primitivos. Na presença de FGF, o BMP4 ventraliza o mesoderma durante a gastrulação de modo que ele forme o mesoderma intermediário e o mesoderma da placa lateral. Chordin, noggin e follistatin antagonizam a atividade de BMP4 e dorsalizam o mesoderma para originar a notocorda e os somitômeros na região da cabeça. A formação dessas estruturas em regiões mais caudais é regulada pelo gene BRACHYURY (T) (ver Figura 5.4A). A lateralidade (assimetria esquerda-direita) é regulada por uma cascata de moléculas e de genes sinalizadores. FGF8, secretado por células no nó e na linha primitivos, induz a expressão de NODAL e de LEFTY2 do lado esquerdo, e esses genes aumentam a expressão de PITX2, um fator de transcrição e gene-chave para a lateralidade esquerda (ver Figura 5.6). O neurotransmissor serotonina (5-HT) também atua na definição da lateralidade por meio da restrição da expressão de NODAL ao lado esquerdo. O posicionamento normal dos órgãos (à esquerda e à direita) é chamado de situs solitus, enquanto sua inversão completa é chamada de situs inversus. Quando um ou mais órgãos estiverem em posição anormal, essa condição será chamada de situs ambiguous ou heterotaxia. Indivíduos com situs inversus correm baixo risco de apresentar outros defeitos congênitos, mas seus filhos correm risco mais elevado, principalmente para cardiopatia. Em contrapartida, os pacientes com heterotaxia correm risco elevado de ter muitos tipos de malformações congênitas e quase todos apresentam algum tipo de anormalidade cardíaca. Erros nos níveis de 5-HT ou a expressão incorreta de genes da via de sinalização da lateralidade, como PITX2, resultam em defeitos de lateralidade, como dextrocardia, situs inversus e anomalias cardíacas. As mutações no fator de transcrição dedo de zinco ZIC3 causam heterotaxia associada ao X com cardiopatias graves e outros defeitos.
As células epiblásticas que se movem pelo nó e pela linha primitivos são predeterminadas por suas posições a se tornarem tipos específicos de mesoderma e de endoderma. Assim, é possível elaborar um mapa de destino do epiblasto mostrando seu padrão (ver Figura 5.7).
No fim da terceira semana, são estabelecidas três camadas germinativas na região da cabeça, consistindo em ectoderma, mesoderma e endoderma, e esse processo continua a produzir essas camadas para as áreas mais caudais do embrião até o fim da quarta semana. A diferenciação tecidual e orgânica já começou e ocorre no sentido cefalocaudal à medida que a gastrulação continua.
Enquanto isso, o trofoblasto progride rapidamente. As vilosidades primárias adquirem um centro mesenquimatoso, no qual surgem pequenos capilares (ver Figura 5.12). Quando esses capilares vilosos fazem contato com os capilares da placa coriônica e do pedúnculo embrionário, o sistema viloso está pronto para fornecer nutrientes e oxigênio ao embrião (ver Figura 5.13).




4- O que é oligospermia
Enquanto a mulher já nasce com o número definido de óvulos (essa quantidade não aumenta), o homem produz espermatozoides ao longo da vida. É por esse motivo que o homem pode ser fértil mesmo em idade mais avançada.
Para ser fértil, o homem precisa apresentar uma quantidade normal de sêmen, cerca de 15 milhões por ml. Caso esse número seja inferior, ele pode ser diagnosticado com oligospermia — ou seja, baixa contagem de espermatozoides.
Veja quais são as suas principais causas
Vários fatores podem causar essa condição:
inflamação dos testículos: pode ocorrer pela ação de vírus e bactérias;
uso de medicamentos: alguns tipos de medicação sem prescrição médica podem causar a condição, principalmente os antibióticos;
varicocele: a doença atinge os vasos testiculares, provocando uma má circulação do sangue na região, que causa um aumento da temperatura local e, consequentemente, a infertilidade.
Entenda como é feito o diagnóstico
O diagnóstico da oligospermia é feito por meio do espermograma, que identifica a quantidade e a qualidade dos espermatozoides produzidos.
Logo, a contagem de espermatozoides é capaz de definir o grau de intensidade da doença. Quanto menor for esse número, mais grave é a oligospermia. No entanto, quando nenhum espermatozoide é detectado no sêmen ejaculado, a condição é denominada azoospermia.
5- Quais fatores influenciam a fertilidade masculina e feminina?
Infertilidade é a dificuldade de um casal obter gravidez no período de um ano tendo relações sexuais sem o uso de nenhuma forma de anticoncepção. Estima-se que a infertilidade atinja 10% a 20% dos casais em idade reprodutiva, independentemente de suas origens étnicas ou sociais. Em aproximadamente 30% dos casos, a infertilidade é causada apenas por fatores masculinos.
Causas:
– criptorquidia (testículos que não desceram): malformação identificada no nascimento do menino, caracterizada pelo posicionamento incorreto do testículo, atrapalhando a produção de espermatozoides. O problema deve ser corrigido na infância para evitar a infertilidade; – fatores genéticos; – fatores hormonais; – infecções, como prostatites, uretrites, infecções urinárias; – obstrução do canal por onde passam os espermatozoides; – varicocele (veias do testículo com dilatação anormal);
Outros fatores: radioterapia, quimioterapia, doenças neurológicas, diabetes, traumas testiculares, drogas, doenças sexualmente transmissíveis.
Feminina
– causas ovarianas e ovulares: Síndrome dos ovários policísticos ou síndrome da anovulação (ausência de ovulação) crônica; insuficiência ovariana prematura ou menopausa precoce; secreção excessiva de prolactina; hipotireoidismo; idade da mulher – basicamente, a partir dos 37 anos;
– causas tubárias e do canal endocervical: Obstrução tubária, geralmente provocada pela endometriose ou infecções pélvicas; alterações na secreção do muco cervical;
– causas ligadas à fertilização: Vigor do espermatozoide e do óvulo; defeitos nos cromossomos ou nas outras estruturas que regulam a fusão dos dois gametas não permite a fertilização; exposição a fatores de risco (raios X, radiações, medicamentos tóxicos) podem dificultar ou impedir a fertilização; idade da mulher;
– causas ligadas à implantação do embrião: A implantação é a penetração do embrião na camada que reveste a cavidade uterina, chamada endométrio. Esse revestimento é preparado para receber o embrião formado após a ovulação e fertilização. Os hormônios femininos (estrógeno e progesterona) são responsáveis pela preparação do endométrio, durante o ciclo menstrual. Portanto, falhas hormonais podem produzir um endométrio inadequado para a implantação.
– DIP - Doença inflamatória pélvica.
6 - A saúde mental interfere na capacidade de engravidar?
Assim como o estresse, existe uma relação clara entre a ansiedade e a fertilidade. A capacidade reprodutiva dos homens e das mulheres são igualmente afetadas por sentimentos e pensamentos ansiosos. O estresse tem a capacidade de ativar o eixo hipotálamo-hipófise-adrenal e assim liberar hormônios.
A ansiedade excessiva pode interferir no ciclo menstrual e na ovulação das mulheres. Ela também eleva a produção do hormônio epinefrina, que causa constante tensão muscular e atrapalha a fecundação. Outro hormônio cuja produção pode ser aumentada desproporcionalmente é a oxitocina, que provoca contrações uterinas.
Já nos homens, a ansiedade pode causar impotência sexual e ejaculação precoce. Deste modo, pode comprometer a capacidade do casal de obter uma gestação e, ainda, diminuir a satisfação da vida sexual.
7- Quais são os principais métodos diagnósticos para infertilidade?
Diagnóstico de infertilidade feminina
Os problemas relacionados à fertilidade feminina são responsáveis por 40% dos casos de dificuldades para engravidar registrados nos consultórios médicos.
As causas para a infertilidade feminina são variadas e dependem de diversos fatores, como por exemplo, idade, predisposições genéticas, disfunções hormonais e estilo de vida.
Sendo assim, para obter um diagnóstico preciso, é fundamental consultar um especialista e realizar alguns exames.
Entre os principais exames que podem ser solicitados para uma avaliação precisa da situação, estão:
Dosagens hormonais
O exame de dosagens hormonais é realizado através de um exame de sangue e serve para verificar os níveis de alguns hormônios importantes relacionados ao ciclo menstrual e à ovulação, como por exemplo, FSH, LH, estradiol, prolactina, função tireoidiana, testosterona, entre outros.
Ultrassonografia transvaginal
A Ultrassonografia Transvaginal serve para detectar doenças na região pélvica, tais como: endometriose, pólipos endometriais (dentro da cavidade do útero), miomas, gravidez nas trompas ou fora da cavidade do útero e tumores de ovários. O exame é realizado através da introdução de uma sonda na vagina.
Histerossalpingografia
A histerossalpingografia é um exame de radiografia (raio-x) que serve para verificar as condições anatômicas do útero e tubas. Além disso, o exame também pode ser feito para investigação de outros problemas ligados à anatomia do útero e das trompas.
Hormônio Anti-Mülleriano
Aqui no blog, já falamos sobre a influência do Hormônio Anti-Mülleriano na fertilidade feminina. O diagnóstico é realizado através de um exame de sangue, que deve ser feito durante o ciclo menstrual da mulher e serve para predizer qual é a quantidade da reserva ovariana existente.
Ressonância magnética de pelve
A Ressonância Magnética (RM) pélvica é um exame de diagnóstico por imagem que serve para avaliar os órgãos que se localizam no abdómen inferior, como por exemplo, o útero e ovários.
Biópsia de endométrio
A biópsia de endométrio é um exame ginecológico que serve para analisar possíveis alterações intra uterinas. O material é colhido dentro do útero e enviado para análise no laboratório.
Videolaparoscopia
A videolaparoscopia é uma cirurgia minimamente invasiva que serve para diagnosticar doenças que acometem a região abdominal e/ou pélvica.
A cirurgia ocorre por meio da introdução de uma pequena câmera através da cicatriz umbilical que possibilita ao médico especialista uma visão detalhada da cavidade abdominal e pélvica, podendo avaliar em alta definição os órgãos e tecidos internos.
Diagnóstico de infertilidade masculina
De acordo com a Organização Mundial de Saúde, a taxa de infertilidade é de cerca de 40% tanto para homens como para mulheres.
No entanto, é importante lembrar que os dados também apontam que 90% dos casais com algum problema de infertilidade acabam tendo bebês depois de passarem por algum tipo de tratamento.
A causa mais comum para infertilidade masculina é a varicocele, no entanto, para obter um diagnóstico preciso, é necessário realizar alguns exames.
A seguir, conheça alguns dos principais exames de diagnóstico para a infertilidade masculina.
Espermograma
O espermograma tem como objetivo avaliar as características do sêmen, como viscosidade, pH e cor, além de quantidade de espermatozoides por ml de sêmen, forma dos espermatozoides, motilidade e concentração de espermatozoides vivos.
A amostra do material é colhida no laboratório e é indicado que o homem não tenha relações sexuais de 2 a 5 dias antes da coleta.
Dosagens hormonais
Tal como nos diagnósticos da infertilidade feminina, os exames de sangue para a dosagem hormonal são também indicados para verificar a fertilidade masculina. No caso dos homens, o exame serve para verificar a dosagem de testosterona, hormônio que estimula a produção de espermatozoides.
Teste pós-coito
O exame é realizado através da coleta do muco cervical da mulher 2 a 12 horas após a relação sexual. Este teste serve para verificar a motilidade dos espermatozóides.
Outros exames
Além dos exames mencionamos, o médico pode solicitar alguns exames adicionais, como o exame de fragmentação do DNA e o exame de anticorpos contra os espermatozoides.
8- O que é o planejamento familiar pelo SUS?
Lei do Planejamento Familiar e a Assistência Integral à Saúde da Mulher
O planejamento familiar faz parte da assistência integral à saúde e deve ser oferecido para todos os brasileiros. A garantia é assegurada pela Lei Federal 9.263/96, vigente há 25 anos. É obrigação do SUS garantir assistência às técnicas de concepção e métodos de contracepção cientificamente comprovados.
Além dos métodos de contracepção, o planejamento familiar do SUS inclui o aconselhamento pré-concepcional e o cuidado pré-natal. Essa medida visa conhecer as expectativas da mulher em relação à gravidez, além de identificar fatores de risco ou doenças que possam interferir na futura gestação.
9- Como acontece a determinação do sexo biológico? Fale sobre o
gene SRY.
A testosterona começa a ser elaborada pelos testículos fetais masculinos por volta da sétima semana de vida embrionária. De fato, uma das principais diferenças funcionais entre os cromossomos sexuais masculinos e os femininos é que o cromossomo masculino tem o gene da região determinante do sexo no Y (SRY) que codifica uma proteína denominada fator de determinação testicular (também denominada proteína SRY). A proteína SRY inicia uma cascata de ativações genéticas que faz com que as células do tubérculo (crista) genital se diferenciem em células que secretam testosterona e, por fim, formam os testículos, enquanto o cromossomo feminino faz com que a crista se diferencie em células que secretam estrogênios.
A injeção de grande quantidade de hormônio sexual masculino em animais prenhes promove o desenvolvimento de órgãos sexuais masculinos no feto, embora este seja do sexo feminino. Também, a remoção dos testículos de feto masculino precoce induz o desenvolvimento de órgãos sexuais femininos.
Assim, a testosterona secretada inicialmente pelas cristas genitais e, posteriormente, pelos testículos fetais é responsável pelo desenvolvimento das características do corpo masculino, incluindo a formação do pênis e do saco escrotal, em vez do clitóris e da vagina. Ainda, a testosterona induz a formação da próstata, das vesículas seminais e dos ductos genitais masculinos, enquanto, ao mesmo tempo, suprime a formação dos órgãos genitais femininos.
10- O que são células tronco embrionárias?
São células com vasto poder de diferenciação celular. São extraídas de embriões e acredita-se que elas podem se transformar em qualquer outra célula do corpo. Por isso possuem maior chance de rejeição ou até maior probabilidade de originarem tumores, em relação às células-tronco adultas.
Acredita-se que durante o desenvolvimento do embrião humano uma complexa rede de sinalizadores físicos e químicos atuem a nível molecular induzindo à diferenciação e proliferação celular, de forma harmônica e ordenada, gerando, assim, os tecidos e órgãos para os quais elas foram geneticamente programadas.
Quanto a sua classificação, podem ser:
Totipotentes: células que são capazes de se diferenciar em todos os tecidos que formam o corpo humano, incluindo a placenta e anexos embrionários. As células totipotentes são encontradas nos embriões nas primeiras fases de divisão, isto é, quando o embrião tem até 16 a 32 células, correspondendo a 3 ou 4 dias de vida;
Pluripotentes ou multipotentes: células capazes de se diferenciar em quase todos os tecidos humanos, excluindo a placenta e anexos embrionários, ou seja, de 32 a 64 células; aproximadamente a partir do 5º dia de vida; fase de blastocisto do embrião;
Oligotentes: células que se diferenciam em poucos tecidos;
Unipotentes: células que se diferenciam em um único tecido.
REFLEXÃO
Achei que a aula de hoje transcorreu muito bem. Há pessoas novas na sala que trazem bastante material, agregando muito na discussão em aula.




Comentários